
Глава 25. Вирусология
Зарождение вирусологии. (М. И. Гольдин)
Основателем учения о вирусах справедливо считается русский ученый Д. И. Ивановский. Первые представления о природе вирусов были изложены им в работе "О двух болезнях табака" (1892) и более полно в диссертации (1902). Он показал, что частицы вирусов в отличие от клеток бактерий проникают сквозь агаровые студни и мелкопористые бактериальные фильтры.
Новым этапом в учении о вирусах явилось открытие У. Стенли: в 1935 г. из сока табака, пораженного мозаичной болезнью, он осадил и очистил в кристаллическом виде вирус мозаики табака (ВТМ) (Нобелевская премия, 1946). В 1936 г. английский ученый Ф. С. Боуден совместно с Н. У. Пири внесли существенную поправку в открытие Стенли. Они показали, что ВТМ состоит не из чистого белка, как считал Стенли, а является нуклеопротеидом. Впоследствии вирусологами разных стран были получены в кристаллическом виде вирусы человека, животных, насекомых и растений. Кристаллическое состояние оказалось особенно характерным для вирусов растений. Выдерживая в пробирках на холоду очищенный препарат ВТМ, Р. Ж. Бест (1940) обнаружил, что взвешенные в жидкости вирусные частицы постепенно агрегировались и оседали на дно в виде длинных стекловидных паракристаллов.
Принципы организации вирусов
В результате применения рентгеноструктурного анализа и электронной микроскопии в сочетании с методами оптической диффракции удалось расшифровать строение простых и сложных вирусов и бактериофагов.
Уже в 1958 г. Р. Франклин и К. Холмс показали, что ВТМ представляет собой полые палочкообразные цилиндрические образования. Дальнейшие исследования А. Клуга, Д. Каспара и других (1958 - 1960) дали новые сведения о макромолекулярной организации ВТМ. Работы Р. Маркхема и К. Смита с вирусом желтой мозаики турнепса положили начало установлению структуры так называемых малых сферических растительных вирусов. Оказалось, что у этих вирусов РНК заключена внутри сферы, построенной из белковых субъединиц (Г. Никсон, А. Гиббс, 1960). Идея о подобной организации малых сферических вирусов впервые была высказана в 1956 г. Ф. Криком и Дж. Уотсоном (лауреаты Нобелевской премии, 1962); П. Уилди, У. Рассел и Р. Хорн (1960) обнаружили, что аналогичной организацией обладают и некоторые простые вирусы животных. Работы Э. Мерцера, С. Бреннера, Д. Кинга и М. Муди способствовали выяснению организации бактериальных вирусов.
X. Френкель-Конрат и Г. Шрамм в конце 50-х годов обнаружили, что белки растительных вирусов способны к самоагрегации. Они образуют структуры, аналогичные вирусу, но не содержащие РНК (Г. Никсон и Г.Вудс, 1960).
Развитие фитовирусологии
Значение теоретических исследований вирусов растений трудно переоценить. Оно далеко выходит за рамки собственно вирусологии. Изучение вирусов растений способствует разработке таких кардинальных общебиологических проблем, как сущность жизненных явлений, передача генетической информации и синтез белка.
Вирусы растений состоят, как правило, из РНК и белка. До 1968 г. такое строение считалось отличительной особенностью этой группы вирусов, пока Р. Шепард не обнаружил наличия двухцепочечной ДНК у вируса мозаичной болезни цветной капусты.
Вся история учения о вирусах неразрывно связана с развитием представлений о нуклеиновых кислотах.
Изучение наиболее важных теоретических проблем вирусологии на вирусах растений позволило выяснить ряд принципиально важных фактов. В 1938 г. Ф. С. Боуден и Н. У. Пири обнаружили, что вирус карликовой кустистости томатов кристаллизуется, образуя ромбические додекаэдры. По данным Р. Маркхема и К. М. Смита (1949), вирус желтой мозаики турнепса кристаллизуется в форме октаэдров. В 1966 г. М. Вейнтрауб и X. У. Рагетли провели электронномикроскопические исследования тканей растений, пораженных вирусом желтой мозаики фасоли, и описали различные формы кристаллических агрегатов этого вируса. Тзен Ан Чен, X. Хируми и К. Мараморош в 1969 г. обнаружили в клетках растений с симптомами вируса пестростебельности картофеля сравнительно длинные палочковидные частицы, собранные в кристаллы. Многие ученые (У. Стенли, Э. Вэленс и др.), изучавшие эти строго организованные образования, сложенные из вирусных частиц, считают их живыми кристаллами.
В 1956 г. одновременно в лаборатории Шрамма в Тюбингене (ФРГ) и в лаборатории Френкеля-Конрата в Беркли (США) предварительно очищенный препарат ВТМ был расщеплен действием фенола на белковую часть вирусной частицы и нити нуклеиновой кислоты. В' отдельности они не проявляли активности. При их объединении инфекционное свойство нуклеопротеида восстановилось. Френкель-Конрат трактовал это явление как реконструкцию, т. е. разборку и сборку частиц вируса. Было показано также, что свойства штамма вируса определяются исключительно нуклеиновой кислотой (см. главу 23).
Более того, по данным М. П. Гордона и С. X. Смита (1960), некоторые растения заражаются свободной нуклеиновой кислотой ВТМ, а не целой частицей нуклеопротеида. Американские ученые А. Зигель, М. Цейтлин и О. П. Зегал (1962) экспериментально получили варианты ВТМ, которые, репродуцируясь в тканях растений, вообще не образуют белковой оболочки. Другой вариант этого вируса, как показали электронномикроскопические исследования, хотя и синтезирует белковые оболочки, но они оказываются необычной формы, и нуклеиновые кислоты не имеют возможности проникнуть в них и образовывать нуклеопротеид. В. Харихарасубраманиан и А. Зигель (1969) выяснили, что у дефектных вариантов ВТМ частицы белка упаковываются беспорядочно и даже образуют конгломераты. При этом нуклеиновые кислоты этих дефектных вариантов ведут себя, как полноценные вирусы.
В последнее время большое внимание привлекает вопрос неспецифичности вирусных и невирусных нуклеиновых кислот в отношении к различным биологически активным веществам. Вот несколько фактов, число которых неуклонно растет. Так, М. Ниренберг* и X. Мэтей (1961) установили, что нуклеиновая кислота ВТМ стимулирует синтетическую реакцию включения аминокислот в пептиды бесклеточных экстрактов кишечной палочки. В 1966 г. Р. Е. Мэтьюз и Ж. Д. Гарди произвели сборку белковой палочковидной части ВТМ с нуклеиновой кислотой сферической части вируса репы. В результате был получен вирус, у которого инфекционное свойство определялось нуклеиновой кислотой вируса репы, а серологические реакции - палочковидной оболочкой ВТМ, собранной из белковых частей (шайбочек). Из шайбочек белковой частицы ВТМ были собраны палочки, характерные для нуклеопротеида ВТМ; внутри оказались шарики нуклеиновой кислоты вируса репы. Еще в 1956 г. была опубликована, но осталась тогда незамеченной работа Р. Г. Харта и Дж. Смита, получивших такие же палочковидные частицы, но только содержащие не вирусную, а дрожжевую кислоту и даже синтетические полимеры рибонуклеопротеидов. Голландские ученые Ж. К. Ван-Равенсвай-Клаазен, А. Б. Ван-Леувен, Г. А. Дуижутса и Л. Бош (1967) поставили следующий опыт: в бесклеточные экстракты кишечной палочки они добавили немного нуклеиновой кислоты вируса мозаики люцерны. Произошла реакция, и из бесклеточных экстрактов бактерий образовался полипептид, весьма сходный с белком частиц вируса мозаики люцерны.
* (За экспериментальное изучение генетического кода М. Ниренбергу в 1968 г. была присуждена Нобелевская премия.)
Весьма существенную роль в развитии фитовирусологии сыграла работа Ж. Г. Атертона (1968). Атертон утверждал, что ему удалось получить репродукцию ВТМ в культуре животных клеток. Его работа базировалась на многочисленных серологических и электронномикроскопических исследованиях и многократных испытаниях на специальных растениях-индикаторах, с помощью которых устанавливается концентрация вируса в исследуемом объеме и многие другие тесты. Это сенсационное сообщение по вопросу, имеющему принципиальное значение, требует дальнейшего подтверждения, тем более, что при помощи электронного микроскопа Атертону не удавалось пока обнаружить вирусные частицы ВТМ внутри животных клеток. Репродукция вируса устанавливалась биологическим путем на тест-растениях, а электронномикроскопически - только в экстрактах клеток.
В ходе глубоких теоретических исследований, проводимых в СССР и за рубежом, было обращено внимание на тот факт, что в различных тканях растений вирусы распределены весьма неравномерно. В эпидермисе, например, много вирусов мозаики табака или мозаики картофеля, а в клетках меристемы, в точках роста, их может не быть вовсе. Предпринимались попытки, пользуясь хорошо разработанной техникой культуры ткани растений, вырезать в стерильных условиях кусочек такой меристемной ткани и вырастить из него целое и притом здоровое растение. Такая операция может стать незаменимой, когда какой-либо ценный сорт растения оказывается целиком зараженным вирусом. В настоящее время таким способом в широких масштабах получают безвирусные растения картофеля, гвоздики, яблони, крыжовника, табака.
Большие работы по выращиванию из верхушечной меристемы свободных от вирусов нарциссов, тюльпанов, гиацинтов и лилий проводятся в Исследовательском институте оранжерейных культур в Литтл-Хемптоне (Великобритания). Они особенно важны ввиду того, что луковичные культуры очень сильно поражаются вирусными заболеваниями, и до сих пор не было найдено радикального способа борьбы с ними.
Различные вирусы растений характеризуются различной температурой инактивации. Наиболее устойчивые, например ВТМ, выдерживают нагревание до 92° в течение 10 мин. Многие вирусы теряют инфекционность после 10-минутного нагревания при температуре 60° и ниже. За счет более длительного воздействия удается вылечить черенки растений от ряда вирусных заболеваний и при более низких температурах прогревания.
Вирус хлороза и волосатости сахарного тростника инактивируется при погружении черенков на 30 мин. в воду, нагретую до 50°. Р. Антойн (1965) обработал таким образом более 16 000 т черенков, пораженных этим вирусом. Затем, предварительно прорастив их в теплицах, он вырастил свободный от вируса сахарный тростник на 1821 га промышленных плантаций. Термотерапия применяется в борьбе с желтухой персика, при некоторых вирусных заболеваниях земляники, картофеля и других культур в тех случаях, когда удается инактивировать вирус и сохранить живыми клетки растения-хозяина. В недавнее время появились работы М. Холингса (1962), Л. Шислера, Я. В. Зиндена и Е. М. Зигеля (1967) и других по вирусным заболеваниям, снижающим урожай шампиньонов. Прогревание субстрата при 33° сразу после внесения колонии гриба приводило к полному оздоровлению культуры шампиньонов.
Вред, причиняемый вирусами растений, очень значителен. ВТМ распространен по всему земному шару. Кроме табака он поражает томаты, петунию, дельфиниум, яблоню и множество других растений. Вирус этот очень устойчив (в сухих растительных остатках он может, например, сохраняться более 50 лет) и исключительно контагиозен. В Англии только в 1949 г. от вирусного заболевания - желтухи свеклы - было недополучено 1 млн т сахара. Во многих странах вырождается от 10 до 50% картофеля, пораженного вирусами. Чтобы в какой-то мере избежать распространения болезни, семенной картофель выращивают в высокогорных районах на высоте 1500-1800 м над уровнем моря или на специальных закрытых участках, защищенных от заноса туда инфекции с ветром или крылатыми формами тлей.
Разработка наиболее эффективных противовирусных мероприятий требует знания характерных особенностей различных вирусов растений. Важно также учитывать сходство и различие между вирусами человека и животных, с одной стороны, и вирусами растений - с другой. Ввиду принципиальных различий в химическом составе, плотности, проницаемости и пластичности оболочек клеток растений и животных закономерности проникновения вирусов в организм и их перехода из клетки в клетку у вирусов человека и животных иные, чем у вирусов растений.
Частицы вирусов растений очень малы. Длина палочки вируса мозаики равна 270 ммк, а поперечное сечение - 15 ммк. Чтобы заразить кусочек чувствительной животной ткани, достаточно погрузить ее в жидкость, содержащую вирус животных или человека. Ткани растений инфицировать таким способом не удается, если предварительно не повредить эпидермис. При решении вопроса, каким путем вирус в природных условиях переходит из клетки в клетку, внимание фитовирусологов привлекли плазмодесмы - канальцы диаметром в 20 - 50 ммк, находящиеся в межклеточных мембранах. По ним из зараженной клетки в соседнюю, очевидно, и проникают вирусные частицы одна за другой или даже парами. Согласно электронномикроскопическим исследованиям, диаметр сферических частиц вируса бронзовости листьев томатов от 80 до 120 ммк, а просвет плазмодесмы в клетках томатов всего 20 - 100 ммк. Но и для более мелких вирусных частиц, таких, как ВТМ или Х-вирус картофеля, прохождение через плазмодесмы затруднительно. Как показывают наблюдения на ультратонких срезах тканей растений, вирусные частицы склонны к агрегации; тогда наступает закупорка канальцев скоплениями вирусных частиц. Возможно, вирус переходит из одной клетки в другую без белковой оболочки. В прямых электронномикроскопических исследованиях М. И. Гольдиным и В. Л. Федотиной (1956) было показано, что даже в пределах однородной ткани распределение частиц ВТМ весьма неравномерно. Очевидно, эта неравномерность связана с трудностями передвижения. Закономерности проникновения вирусных частиц в ткани растения извне, их перемещения из клетки в клетку, из ядра в цитоплазму, из цитоплазмы в ядро, хлоропласты, митохондрии и рибосомы относятся к числу наиболее актуальных вопросов современной фитовирусологии.
Изучение путей распространения вирусов в природе и их передачи от больных растений к здоровым обнаружило, что в ряде случаев (например, при заболеваниях винограда, томатов, смородины, огурцов) основными переносчиками являются нематоды, и заражение осуществляется через почву. Оказалось, что между нематодами и вирусами существуют сложные взаимоотношения. Например, вирусные заболевания винограда передаются строго определенным видом нематоды, в организме которой они сохраняются дольше, чем в почве. Вирус кольцевой пятнистости табака остается активным в организме нематоды Xiphinema americanum более 8 месяцев.
Вирусная болезнь салата (big-vein) продолжала распространяться в условиях, когда все известные пути распространения вируса были исключены. Р. Кампбел (1962) установил, что переносчиками возбудителя являются зооспоры плесневого гриба Olpidium brassicae, в которых вирусные частицы способны сохраняться длительное время. Споры гриба, паразитирующего на салате, зараженном вирусом, распространяются ветром на большое расстояние. Оседая на листьях здоровых растений, они прорастают и вносят таким путем вирусные частицы в клетки салата. Этот же гриб служит переносчиком вирусов некроза табака, карликовости табака и других. Зооспоры О. brassicae, инфицированные вирусом карликовости табака, передавали инфекцию 35 видам растений, относящимся к 13 семействам. На I Международном конгрессе фитопатологов в Лондоне (1968) Р. А. Джонс сделал сообщение о вирусе парши картофеля, передаваемом грибом Spongospora subterrunae. Вирус способен сохраняться в спорах этого гриба более года. Аналогичные соотношения установлены между грибом Tolymyxa graminis и вирусом мозаики пшеницы, а также между многими другими вирусами и грибами.
Как показали многочисленные исследования, низшие грибы служат не только переносчиками вирусных заболеваний, но в ряде случаев и сами поражаются вирусами. По данным Э. Эллиса и У. Клейншмидта (1967), в мицелии гриба Penicillium stoloniferum были обнаружены вирусные частицы диаметром 25 - 30 ммк. У больных грибов уменьшался объем мицелия, но лизиса не наблюдалось. Интересно, что эти пораженные вирусом грибы стимулировали образование противовирусного белкового вещества - интерферона в клетках животных и в культуре ткани-До сих пор было известно, что интерферон возникает в организме человека или животных в ответ на вирусное заболевание. Исследования Эллиса и Клейншмидта показали, что вирусное заболевание - довольно частое явление у Penicillium stoloniferum, Aspergillus glaucus и других грибов.
Противоречивые результаты были получены при исследовании на полях и в лабораториях вируса некроза табака. Постепенно выяснилось, что в вытяжках клеток растений, пораженных этим вирусом (точнее двумя вирусами), закономерно обнаруживаются частицы двух размеров. В частицах меньших размеров (17 ммк) умещается всего 1160 нуклеотидов, что недостаточно для их самостоятельного существования, и они способны репродуцироваться лишь при участии другого вируса, более крупных размеров. Такие мелкие вирусы получили название вирусов-сателлитов. К. Мундрей (1963) указывает, что вирус-сателлит содержит недостаточное количество информации для своей репродукции в клетке хозяина, но может репродуцироваться, если к нему добавить другой вирус большего размера. Другими словами, один вирус определяет наследственные свойства другого. Сложные взаимоотношения двух вирусов понемногу выясняются. Установлено, например, что вирус-сателлит не гибнет после 10-минутного прогревания при 90° и сохраняется значительно дольше в растительных остатках почвы, чем обыкновенный вирус некроза табака. Однако до понимания сущности этих взаимоотношений еще далеко.
До сих пор предметом споров остается вопрос о том, в каких участках клетки растения происходит формирование вирусных нуклеиновых кислот - в ядре, цитоплазме, хлоропластах или митохондриях. Решение этого вопроса имеет принципиальное значение для выяснения природы вирусов. Известно, что вирусы нормально репродуцируются в культуре тех растительных тканей (в том числе в тканях корней), клетки которых лишены хлоропластов. Д. Е. Шлегель, С. X. Смит и Г. А. де Цоетен (1967) разделяют распространенную точку зрения, согласно которой в ядре образуется вирусная нуклеиновая кислота, а в цитоплазме происходит синтез белковой оболочки и сборка полной вирусной частицы. К. Исау и Р. X. Гил (1969) считают, что эта концепция не вяжется с фактом обнаружения вирусного нуклеопротеида в ядре. Как было показано М. II. Гольдиным (1963), вирусные включения казахского штамма ВТМ появляются в цитоплазме постоянно на 2 - 3 дня раньше, чем в ядре. Если бы репродукция этого вируса происходила первоначально в ядре, то и включения, представляющие собой агрегаты вирусных частиц, должны были бы образоваться в ядре раньше, чем в цитоплазме. Можно было бы допустить, что вирусные частицы, репродуцируясь в ядре, проникают затем в цитоплазму, где накапливаются в достаточном количестве, и только после насыщения ими цитоплазмы начинают агрегироваться, образуя включения в ядре. Но это допущение противоречит тому факту, что, возникнув в ядре, включения продолжают расти и выступают из него в виде длинных нитей в цитоплазму, где уже имеются цитоплазматические нитевидные включения. Р. Е. Мэтьюз (1968) сообщает, что его опыты по действию 2-тиоурацила на репродукцию вируса репы свидетельствуют о том, что синтез вирусной белковой оболочки происходит независимо от синтеза вирусной рибонуклеиновой кислоты, которая только и является инфекционным началом. Что касается места формирования собственно вирусной нуклеиновой кислоты, то по этому вопросу даже в отношении одного и того же вируса имеются прямо противоположные суждения. Следует, однако, отметить, что обнаружение вирусных частиц в цитоплазме или в ядре еще не означает, что, вирусная нуклеиновая кислота образовалась именно в этих частях клетки. Чтобы проследить за процессом формирования вирусной нуклеиновой кислоты, потребуются более совершенные методы исследования.
К вирусным заболеваниям растений долгое время относили группу так называемых "желтух", в которую входят столбур томатов, желтуха астр, карликовость шелковицы, "ведьмины метлы" картофеля и многие другие весьма распространенные заболевания растений. Желтухи передаются от больного растения к здоровому только прививкой, а в природных условиях только с помощью цикадок. Эти заболевания характеризуются своеобразным израстанием цветков, уродством кустов, хлорозом и уменьшением размеров листьев. В СССР столбурное заболевание томатов и других пасленовых было изучено К. С. Суховым и А. М. Вовком (1946). Они выявили переносчика столбура - цикадку Hyalesthes оbsoletus. В дальнейшем вирусологи СССР и других стран интенсивно изучали столбурное и другие заболевания типа желтух, не сомневаясь в их вирусной природе. Но в 1967 г. японские ученые Я. Дои, М. Теренака и другие обнаружили при помощи электронного микроскопа во флоэме шелковицы (карликовость), астр (желтуха), картофеля (ведьмина метла) микоплазмоподобные организмы. Вскоре микоплазмоподобные организмы были найдены не только в тканях растений, пораженных различными желтухами, но и в тканях цикадок - переносчиков этих заболеваний. У здоровых растений и цикадок их не обнаруживали. В связи с этим открытием вирусная природа желтух растений была поставлена под сомнение, и до сих пор вопрос об истинной природе возбудителя этого заболевания остается одной из наиболее важных проблем фитовирусологии.
Возникновение и развитие учения о вирусах бактерий. (Я. А. Парнес)
Открытие вирусов бактерий было подготовлено развитием микробиологии в конце XIX в. Идеи Л. Пастера о бактериальной этиологии инфекций, разработанные в 80-х годах методы культивирования бактерий на плотных и жидких питательных средах, утверждение в микробиологии идей мономорфизма - все это способствовало изучению морфологических и физиологических особенностей бактерий. Среди других феноменов роста бактерий было описано явление их спонтанного лизиса.
Впервые спонтанное растворение бактериальной культуры было обнаружено в 1892 г. В. Крузе и С. Пансини при изучении роста пневмококка. Спустя четыре года русский бактериолог М. Ганкин (1896) сообщил о бактерицидном действии воды Джамны и Ганга на холерного вибриона. Автор обнаружил сохранение бактерицидных свойств воды этих рек после ее пропускания через бактериальный фильтр. Растворение сибиреязвенных палочек в дистиллированной воде описал в 1898 г. Н. Ф. Гамалея, назвавший это явление бактериолизом. Он объяснил его выделением бактериями специфического вещества - бактериолизина. Исследования многих бактериологов показали, что лизис бактерий может быть обусловлен различными факторами (протеолизом, образованием аутотоксинов и др.).
Открытие вирусов бактерий принадлежит английскому бактериологу Ф. Туорту. В 1915 г. он установил, что выделенный им литический агент способен проходить через бактериальный фильтр, оказывать патогенное действие и длительно пассироваться, т. е. отвечал основным критериям вируса, выдвинутым Д. И. Ивановским (1892, 1902). Спустя два года аналогичное открытие сделал канадский бактериолог Ф. д'Эрелль (1917), высказавший со всей определенностью, в отличие от Туорта, гипотезу о живой природе агента и назвавший его бактериофагом.
Второй период в изучении вирусов бактерий (1917 - 1938) связан с развитием вирусной теории бактериофагов и формированием представлений о лизогении. Гипотеза д'Эрелля, согласно которой бактериофаг является ультрамикробом (вирусная гипотеза), определила дальнейшее развитие учения о вирусах бактерий. Она поставила два вопроса - какими свойствами живых организмов обладают вирусы бактерий и какие химические и структурные особенности этих вирусов обусловливают их воспроизведение в бактериях?
Идея о паразитарной природе фага, о возможности его применения для лечения и профилактики инфекционных болезней (д'Эрелль, 1919) привлекла к бактериофагу внимание микробиологов всего мира.
Особенно интенсивно исследования по использованию фагов* в медицинских целях развернулись в СССР. Так, первый в мире Научно-исследовательский институт бактериофагии был организован в 1935 г. в Тифлисе, а проблемы бактериофагии широко изучались в большинстве микробиологических институтов и лабораторий нашей страны (В. П. Крестовникова, 1930; Н. Ф. Гамалея, 1930; Е. И. Коробкова, 1937; 3. В. Ермольева, 1939 и др.).
* (Так начиная с 40-х годов для краткости стали называть бактериофаг.)
Наряду с исследованиями, направленными на практическое использование бактериофага, проводились работы по выяснению его природы. Особенно упорно изучал свойства бактериофага Ф. д'Эрелль (1921). Он описал два способа определения числа частиц бактериофага: путем лизиса бульонных культур бактерий при внесении прогрессивно уменьшающихся концентраций бактериофага, вплоть до разведения лизата, когда вносятся единичные частицы фага ("конечное разведение"), и по числу образуемых "стерильных" пятен при посеве разведения лизата на бактериальный газон на плотной питательной среде (метод "стерильных" пятен). Этот второй метод в модификации А. Грациа (1936) широко применяется и сейчас. Изучая взаимодействие бактериофага и бактерий, д'Эрелль отметил ряд этапов в этом процессе: прикрепление фага к поверхности клетки, внедрение его внутрь клетки и размножение в ней, завершающееся лизисом клетки и выходом из нее 15 - 25 частиц бактериофага. Ему удалось наблюдать в темном поле микроскопа лизис бактериальной клетки и появление 15 - 25 мельчайших "блестящих" точек. Число их точно соответствовало количеству стерильных пятен, образуемых при высеве лизата на бактериальный газон. На основании этого д'Эрелль сделал верный вывод, что эти "блестящие" точки являются частицами бактериофага. Он привел также ряд других доказательств корпускулярности бактериофага: способность его проходить через бактериальные фильтры определенной пористости, осаждение в жидкости при длительном стоянии и др. Д'Эрелль отметил изменчивость бактериофага (объясняя ее способностью фага к адаптации), а также автономность антигенного состава фага. Д'Эрелль считал, что существует только один вид бактериофага - Bacteriophagum intestinale, являющийся внутриклеточным паразитом бактерий.
Представления д'Эрелля разделялись далеко не всеми микробиологами. Они противоречили господствовавшей в биологии концепции, согласно которой клетка является минимальной единицей жизни. Зависимость размножения фага от роста бактерий, обнаружение у фага нечувствительности к действию антисептиков, отсутствие у него обмена веществ привело к появлению гипотез о неживой природе фага. Вирусной гипотезе фага был противопоставлен ряд других: "неживой экзогенной природы агента" (Т. Кабешима, 1920; А. Кутнер, 1921), "неживого агента бактериального происхождения", "извращенного обмена веществ" (Ж. Бор-де, М. Чиука, 1920; В. Дэвисон, 1922; Р. Дерр, 1922; Е. Джоруп, 1925). Развернулись острые и продолжительные научные дискуссии между сторонниками живой и неживой природы бактериофага, стимулировавшие экспериментальные исследования.
Наибольшее значение для развития вирусной теории фагов имели работы австралийского бактериолога Ф. Бернета (1929 - 1936) и венгерского биохимика М. Шлезингера (1932 - 1936). Вернет установил, что существуют различные фаги, отличающиеся по своим физическим, физиологическим и серологическим свойствам. Он показал, что адсорбция фага на бактерии является специфическим процессом и что фаг может адсорбироваться только определенным участком поверхности клетки (рецептором). Поэтому каждый фаг активен только в отношении ограниченного круга штаммов бактерий. Вернет (1936) описал мутанты бактериофагов. Он разработал также метод определения размножения бактериофага в отдельных бактериальных клетках и доказал, что в зараженной бактериальной клетке накапливаются бактериофаги, которые при лизисе клетки внезапно выделяются в окружающую среду. Шлезингер (1932) путем определения скорости осаждения частиц фагов при центрифугировании определил их размеры (20 - 90 нм). Сходные величины были установлены У. Элфордом и К. Эндрюсом (1932) при пропускании фагов через бактериальные фильтры с градуированным диаметром пор. Шлезингер (1933) первым установил, что бактериофаг представляет собой нуклеопротеид, состоящий из примерно равных количеств белка и нуклеиновой кислоты, которую он в 1936 г. идентифицировал с помощью реакции Фёльгена как ДНК. Шлезингер (1936) отметил сходство состава активного препарата фага и хроматина.
Таким образом, к концу 30-х годов было установлено, что бактериофаги характеризуются автономностью, строго определенными размерами, отличаются от бактерий физиологическими, серологическими свойствами, химическим составом (нуклеопротеиды) и в этом отношении сходны с вирусами растений и животных. Выделение ВТМ в виде кристаллов, обладающих всеми свойствами вируса (У. Стенли, 1935), и выявление его нуклеопротеидной природы (Ф. Боуден, Н. Пири, 1936) указывало на то, что способность вирусов к размножению связана с последней.
Развитие представлений о лизогении
Открытие лизогенных бактерий, способных подвергаться спонтанному лизису, привело к появлению гипотез о бактериальном происхождении фага. Д'Эрелль и другие сторонники вирусной природы фага отрицали существование лизогенных бактерий, считая, что они лишь загрязнены фагом. Однако вскоре были установлены факты, свидетельствующие о существовании лизогенных бактерий. В 1921 г. О. Байль обнаружил спонтанный лизис бактериальной культуры, ранее не проявлявшей признаков лизиса. Из единичных колоний Е. coli были выделены клоны, одни из которых продуцировали фаг, а другие не обладали этим свойством (О. Байль, 1925; Ж. Борде, 1925). Наконец, Е. Мак-Кинли (1925) установил сохранение лизогенными бактериями способности образовывать фаг даже после продолжительного выращивания в присутствии антифаговой сыворотки. Это доказало независимость спонтанного лизиса от наличия в культуре фага.
Мысль об отсутствии противоречия между существованием лизогенных бактерий и вирусной природой фага впервые высказал Бернет (1929). Стойкое сохранение признака лизогенности в культурах лизогенных бактерий в условиях, исключающих существование свободного фага, а также установленный им факт отсутствия инфекционных частиц фага в разрушенных лизогенных клетках он объяснил тем, что в лизогенных клетках фаг находится в неинфекционной форме в виде зачатка, способного под действием невыясненных причин превращаться в фаг. Оставалась неясной природа "зачатка": является ли он латентным вирусом или структурой, связанной с генетическим аппаратом клетки. Ответ на этот вопрос дали исследования голландца Л. Доорен де Ионга (1931), установившего, что споры лизогенной культуры Вас. megaterium сохраняют свойство лизогенности при 100°. Поскольку фаги инактивируются уже при 75°, Доорен де Ионг высказал мысль, что "зачаток" не может быть латентным вирусом и что фаг образуется в лизогенных бактериях de novo. Однако правильный вывод Доорен де Ионга был поставлен под сомнение в связи с выявлением терморезистентности обезвоженных фагов (А. Веддер, 1932).
Изучение лизогении послужило отправным пунктом для формирования гипотез о наследственной природе этого явления. Первая из них была высказана Ж. Борде* в 1923 г., который пришел к идее "инфекционной наследственности" лизогенных бактерий. Однако он не связывал с понятием наследственности определенные материальные структуры, а подразумевал под этим явлением "динамическое равновесие" протекающих в бактериях процессов.
* (За разработку теории гуморального иммунитета Ж. Борде в 1919 г. была присуждена Нобелевская премия.)
Хромосомная теория наследственности нашла свое отражение в гипотезах О. Байля (1925) и особенно Е. Вольмана (1928). Развивая идеи Борде об инфекционной наследственности, Вольман впервые связывает лизогению с наличием материальных носителей "наследственных факторов", характеризующихся простотой организации и способных передаваться во внешней среде. Он постулирует наряду с хромосомным механизмом передачи наследственных факторов существование особого механизма их передачи - посредством окружающей клетку среды ("инфекционная наследственность"). Гипотеза инфекционной наследственности, связавшая такие различные феномены, как наследственность и инфекция, привела в дальнейшем к концепции эписом. В 1933 г. супруги Е. и Е. Вольман высказали гипотезу, что фаг существует в двух формах - инфекционной и неинфекционной. По их мнению, при литической реакции происходит чередование инфекционной и неинфекционной фаз в цикле размножения фага. Они предполагали, что фаги в лизогенных бактериях образуются при каждом делении клетки из структур, их не содержащих. Сохранение способности образовывать фаг в лизогенных бактериях осуществляется, по мнению авторов, благодаря наследственному аппарату клетки.
Гипотеза чередования инфекционной и неинфекционной фаз в отношении лизогенных бактерий не подтвердилась, но она способствовала открытию неинфекционной фазы в цикле размножения фага. В 1938 г. американский биохимик Дж. Нортроп, прославившийся своими работами по получению протеолитических ферментов в кристаллической форме (Нобелевская премия, 1946), на основании произвольной аналогии между бактериофагом и ферментом желатиназой, секретируемым культурой лизогенной бактерии, высказал гипотезу, что фаги выделяются лизогенными бактериями в процессе их роста (гипотеза "секреции";. Эта гипотеза вследствие высокого научного авторитета Нортропа получила признание у большинства его современников.
Удобство экспериментов с фагами и такое же высокое содержание ДНК в их нуклеопротеиде, как и в хромосомах высших организмов (М. Шлезингер, 1936), вызвало огромный интерес к репродукции фагов как модели для выяснения природы гена. Именно удобство такой модели побудило физика-теоретика М. Дельбрюка заняться в 1939 г. изучением вирусов бактерий.
С деятельностью Дельбрюка связан третий период в изучении фагов (1939 - 1953), который характеризуется формированием основ современного учения о вирусах бактерий. Этот период ознаменован фундаментальными исследованиями размножения фагов, их генетических свойств, морфологии частиц, раскрытием природы лизогении, разрешением противоречий между вирусной и генной теориями, а также открытием генетической роли ДНК фагов.
В 1939 г. М. Дельбрюк совместно с Э. Эллисом разработали метод, изучения одиночного цикла размножения фагов, который лег в основу их современных количественных исследований. Применение этого метода позволило выявить в цикле размножения фага три этапа: адсорбцию фага бактерией, скрытый период и период лизиса ("взрыва" клетки), сопровождающийся выделением нескольких десятков частиц фага. Было доказано, что обязательным условием высвобождения фага из бактериальной клетки является ее лизис. Но оставалось неясным, что происходит в зараженной бактериальной клетке в скрытый период.
Применение генетических методов дало возможность обнаружить рекомбинанты в потомстве фагов, полученном при заражении бактерий мутантами двух близкородственных фагов (М. Дельбрюк, В. Бейли, 1946;. А. Херши, 1946)*. А. Дёрман установил, что после заражения клетки фаг переходит в неинфекционную форму, интенсивно размножаясь и давая рекомбинанты, которые он назвал вегетативным фагом.
* (За работы по генетике бактерий и вирусов М. Дельбрюку, А. Херши и С. Луриа в 1969 г. была присуждена Нобелевская премия.)
Открытие рекомбинантов у фагов положило начало новому направлению - генетике фагов. Применение генетических методов позволило А. Херши и Р. Ротман (1948, 1949) построить первую генетическую карту фага Т2, представленную тремя группами сцепления.
Важное значение имело применение при исследовании фагов электронной микроскопии, меченых атомов и других методов микроанализа. Электронномикроскопические исследования (С. Луриа, Т. Андерсон, 1942) вскрыли сложное строение частицы фага Т2, состоящей из головки и отростка. Присоединение фага к поверхности клетки только отростком (Т. Андерсон, 1952) указывало на то, что он представляет собой структуру, обеспечивающую адсорбцию фага. О локализации ДНК в головке фага и ее значении свидетельствовали опыты по образованию "теней"- пустых белковых оболочек фага, освобожденных от ДНК осмотическим шоком (Р. Херриот, 1951) и способных убивать клетки хозяина без размножения в них.
Роль белка и ДНК фага при инфицировании бактерий была установлена при помощи изотопов 14С и 15N А. Херши и М. Чейз (1952). Авторы выявили в механизме заражения бактерий фагом два основных принципа. Первым этапом размножения фага является освобождение его ДНК из белкового чехла, который в дальнейшем перестает функционировать. Одной ДНК достаточно, чтобы вызвать инфекцию. Тем самым было показано, что фаг как таковой не проникает в бактерию и что размножению фага дает начало не родительская частица, а ее ДНК.
Эта работа явилась вехой в развитии учения о вирусах бактерий. Она раскрыла функциональную роль компонентов частицы фагов, механизм заражения бактерий вирусом и убедительно доказала генетическую роль ДНК вирусов бактерий. Хотя значение ДНК как наследственного вещества было установлено еще в 1944 г. при изучении трансформирующего агента пневмококка, только эта работа привела к резкому изменению взглядов на природу гена. Она поставила также ряд важнейших вопросов, определивших последующее развитие вирусологии: каков механизм репликации ДНК вирусов бактерий, каким образом вирусная ДНК "определяет синтез специфических вирусных белков?
Расшифровка природы лизогении
Несоответствие гипотезы "секреции" Нортропа фактам, установленным в 40-х годах Дельбрюком, привело к дискредитации не только этой гипотезы, но и самого феномена лизогении, задержав развитие этой проблемы на 10 лет. Изучение лизогении было возобновлено в 1949 г. в институте Пастера французскими учеными А. Львовым и А. Гутман. В 1950 г. они установили сохранение у единичных клеток лизогенного штамма бактерий в отсутствие бактериофага признака лизогенности в течение 19 генераций, доказав тем самым наследственную природу лизогении. Этот факт нельзя было отнести за счет адсорбированных частиц фага, так как в этом случае их число составило бы 2 19 и они заняли бы объем, во много раз превышающий размеры клетки. Львов и Гутман раскрыли также механизм образования фага лизогенными бактериями, показав, что фаг всегда выделяется только в результате лизиса клетки-хозяина. В том же году А. Львов, Л. Симинович и Н. Кьелдгаард установили способность ультрафиолетовых лучей индуцировать лизис лизогенных бактерий. В 1953 г. Львов создал унитарную концепцию лизогении, в которой он, так же как и ранее Бернет, объяснял все свойства лизогении бактерий наличием в них неинфекционного зачатка, названного им профагом (Нобелевская премия, 1965). Принципиально новым в гипотезе Львова является взгляд на профаг как генетический компонент фага, способный индуцироваться под действием ультрафиолетовых лучей. Профаг интегрирован с генетическим аппаратом клетки и продуцируется координированно с ним. Качественное различие в поведении профага и неинфекционной формы фага в случае продуктивной реакции (гонофага) состоит в том, что первый никогда не размножается, а гонофаг размножается, переходя в вегетативную фазу жизненного цикла, завершающуюся образованием инфекционных частиц фага. Различие в поведении профага и гонофага автор связывает с блокированием в профаге генов, ответственных за продуктивную реакцию. При лизогенизации происходит редукция генома фага в определенном участке хромосомы бактерии. Превращение профага в гонофаг при индукции Львов объясняет разрывом слабой связи между профагом и бактериальной хромосомой. Все фаги по их способности вызывать продуктивную или лизогенную реакцию он подразделяет на вирулентные и умеренные. Концепция Львова была по существу эвристической.
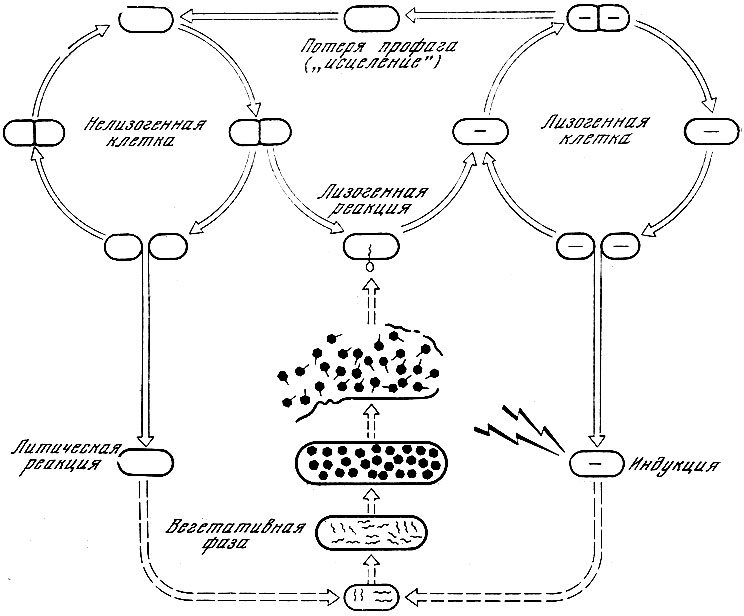
Общая схема лизогении (по А. Львову, 1953)
Экспериментальная проверка этой концепции стала возможна в результате открытия Э. Ледерберг (1951) лизогенности у штамма К12 Е. coli, способного осуществлять конъюгацию, сопровождающуюся образованием рекомбинантов (Дж. Ледерберг, Э. Тейтум, 1946)* и выделением ею умеренного фага, названного лямбда (фаг λ). Это открытие создало основу для систематического изучения лизогении.
* (За работы по генетике микроорганизмов эти исследователи совместно с Дж. Биллом были удостоены в 1958 г. Нобелевской премии.)
В 1951 г. В. Фримен обнаружил явление лизогенной конверсии - образование токсигенных штаммов дифтерийной палочки из нетоксигенных после контакта последних с умеренными дифтерийными фагами. Приобретение бактерией новых наследственных признаков в результате лизогенной конверсии связано, видимо, с внесением новой генетической информации фага, поскольку при утрате профага клетка теряет приобретенные признаки (см. также главу 7).
В 1952 г. Н. Циндер и Дж. Ледерберг открыли феномен трансдукции - направленного переноса умеренным фагом генетической информации от бактерии-донора к бактерии-реципиенту. При трансдукции происходит перенос одного из признаков бактериальной клетки - способности синтезировать какую-либо аминокислоту или сбраживать тот или иной углевод. Приобретение трансдуцированной бактерией только селективных признаков указывало на способность фага захватывать лишь незначительную часть генома бактерии-донора (см. также главу 7).
В 1953 г. Б. Стокер, Н. Циндер и Дж. Ледерберг выявили возможность переноса у сальмонелл трансдуцирующим фагом от одной бактерии к другой двух генов, один из которых определяет наличие жгутика, а другой - его антигена. Трансдукция двух рядом расположенных генов указывает на их тесное сцепление и, наоборот, обособленный перенос генов свидетельствует о расположении их в хромосоме относительно далеко друг от друга. Таким образом, феномен трансдукции явился важным инструментом определения локализации генов в хромосомах бактерий и построения их генетических карт.
Четвертый период (с 1953 г.) характеризуется появлением новых направлений - молекулярной биологии и молекулярной генетики вирусов бактерий. Открытие генетической функции ДНК стимулировало исследования ее структуры. Предложенная Дж. Уотсоном и Ф. Криком (1953) модель строения молекулы ДНК в виде двойной спирали и установление принципа комплементарности ее оснований объяснили генетические свойства ДНК фагов - способность к репликации, мутированию и рекомбинации - и позволили сделать важные предсказания, определившие развитие молекулярной биологии вирусов бактерий. Так, на основании принципа комплементарности оснований ДНК Уотсон и Крик постулировали полуконсервативный механизм ее репликации (см. главу 24). Репликация ДНК фагов Т-серии, как показала А. Роллер (1961), осуществляется при помощи ферментов ДНК-полимераз (А. Корнберг, 1959). Точный механизм ее еще не известен. Р. Окасаки и другие (1968) указывают, что при репликации образуются короткие отрезки ДНК, которые сшиваются между собой ферментом ДНК-лигазой.
Открытие фага φХ174, содержащего однонитчатую ДНК (Р. Синсхеймер, 1959), не только не опровергло, но, наоборот, подтвердило универсальность полуконсервативного механизма репликации ДНК у вирусов бактерий. Оказалось, что после проникновения в клетку одноцепочечной ДНК фага φХ174, так называемой "плюс"-цепи, на ней формируется комплементарная ей "минус"-цепь и в результате образуется двухцепочечная репликативная форма. "Минус"-цепь и служит матрицей для синтеза информационной РНК фага φХ174 (Р. Синсхеймер, 1968).
В 1968 г. М. Гулиан, А. Корнберг и Р. Синсхеймер, используя препараты ДНК-полимеразы и лигазы из Е. coli, осуществили репликацию ДНК фага φХ174 de novo.
Генетические исследования с использованием большого числа различных мутаций фагов Т2 и Т4 показали, что все их гены имеют одну группу сцепления (Р. Стрейзингер, В. Брюс, 1960). В 1963 г. Р. Стрейзингер, Р. Эдгар и Г. Денхардт при тригибридном скрещивании различных мутантов фага Т4 обнаружили, что между генетическими локусами, расположенными в крайних точках линейной карты, рекомбинанты не образуются. Отсюда они сделали вывод, что генетическая карта этого фага представляет кольцо. Применение условно-летальных мутантов, открытых у фага Т4, соответствующие мутации которых располагаются во всех секторах карты, позволило получить более точное представление о генетической карте фага Т4.
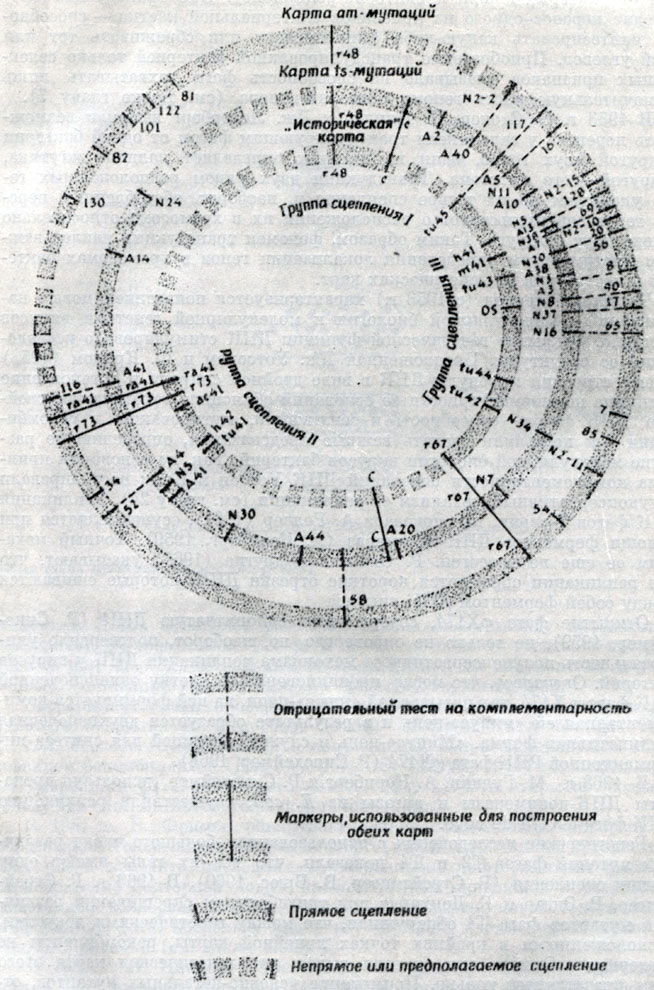
Кольцевая генетическая карта фага Т4 (по Г. Стенту, 1971). Построена на основе сравнительного анализа сцепления на 'исторической карте' и на картах условнолетальных am- и ts-мутаций
Важное значение для развития молекулярной генетики вирусов бактерий имели работы С. Бензера (1955), установившего тонкое строение гена rII фага Т4. Он показал, что этот ген состоит из двух функциональных участков, названных им цистронами А и В, которые содержат по 1000 - 15 000 нуклеотидов. Каждый цистрон состоит из большого числа единиц мутаций (мутонов) и рекомбинаций (реконов). Мутон, по мнению автора, соответствует одному нуклеотиду, а рекон - шести.
Таким образом, работы Бензера позволили представить ген и его компоненты в виде определенного числа нуклеотидов. Обнаружение в гене rII фага Т4 двух рядом расположенных цистронов привело к изменению представлений о природе связи между геном и определяемым им признаком. Вместо установленной биохимической генетикой зависимости "один ген - один фермент" получает признание формула "один ген - один полипептид", согласующаяся с данными о наличии в ряде активных белков нескольких полипептидных цепей. Выявление определенного порядка локализации цистронов в области rII фага Т4, контролирующего синтез активного белка, пролило свет на механизм связи между геном и ферментом: линейный порядок расположения цистронов обусловливает последовательный синтез соответствующих полипептидов, входящих в состав активного белка.
Работы Бензера способствовали решению проблемы генетического кода и познанию механизма мутаций. Именно используя область гена rII фага Т4 в качестве модели, Ф. Крик, Л. Барнет, С. Бреннер и Р. Уоттс-Тобин (1961) установили общую природу записи генетической информации для белков, а Э. Фриз (1961), С. Бреннер, Л. Барнет и Л. Оргель (1961) выяснили природу точечных мутаций (см. главу 24).
В 1961 г. Н. Циндер и Т. Лёб открыли новый класс вирусов бактерий. Они выделили фаги f1 и f2, размножающиеся только в мужских штаммах бактерий (F+ и Hfr). Подобное ограничение обусловлено тем, что для адсорбции этих фагов необходимы F-пили, находящиеся только на поверхности мужских бактерий. Детали механизма проникновения фагов f1 и f2 не выяснены. Вскоре были открыты другие фаги, специфичные к мужским штаммам; многие из них напоминают f1 или f2. С фагом f1 оказались сходны фаги fd, M13 и F12, с фагом f2 - фаги MS2, fr и R27. Поэтому эти два семейства фагов условно обозначают символами f1 и f2.
Фаг f1 оказался мелким фагом, содержащим одноцепочечную ДНК, как и фаг φХ174. Но в отличие от последнего он содержит вдвое больше белка и имеет форму длинной изогнутой палочки. Механизм репликации ДНК фага f1 такой же, как у фага φХ174.
Фаг f1 отличается от всех вирусов бактерий способом его выделения из зараженной клетки-хозяина: секретирующие его клетки Е. coli продолжают расти и размножаться и никакого лизиса при этом не происходит. Так, спустя более 20 лет после того, как в опыте с одиночным циклом размножения фага было доказано высвобождение фагов только путем лизиса клетки, оказалось, что сторонники гипотезы "секреции" не так уж сильно ошибались.
Лёб и Циндер (1961) установили, что фаг f2 является мелкой сферической частицей, содержащей одноцепочечную РНК. Знание механизма репликации одноцепочечной молекулы ДНК фага φХ174 навело авторов на мысль, что в зараженных фагом f2 клетках РНК может находиться в двухцепочечной репликативной форме, что было установлено при помощи меченых атомов и седиментационного анализа. Авторы предложили следующую схему механизма репликации РНК фага f2. Одноцепочечная родительская цепь РНК, так называемая "плюс"-цепь, используется в качестве матрицы для синтеза комплементарной "минус"-цепи; в результате образуется двухцепочечная репликативная форма, "минус"-цепь которой служит матрицей для синтеза "плюс"-цепей РНК. До окончания синтеза первой дочерней "плюс"-цепи на репликативной форме начинается синтез второй, третьей, четвертой дочерних "плюс"-цепей. В итоге репликативная форма превращается в так называемый репликативный промежуточный продукт, состоящий из двухнитчатой РНК и нескольких однонитчатых РНК. На поздних этапах латентного периода содержание репликативной формы и репликативного промежуточного продукта достигает окончательного уровня, число частиц увеличивается, пока процесс репродукции не завершается лизисом клетки.
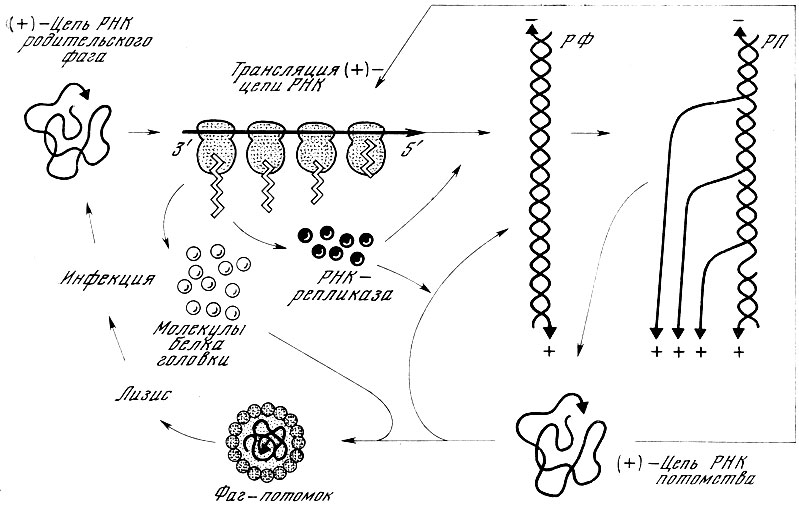
Общая схема внутриклеточного развития РНК-содержащего фага и его репликации (по Г. Стенту, 1971). РФ - двухцепочечная репликативная форма, состоящая из 'плюс'- и 'минус'-цепей, синтезируется под действием фермента РНК-репликазы; РП - репликативный промежуточный продукт, состоящий из 'минус'-цепи РНК и нескольких 'плюс'-цепей, синтезирующихся друг за другом на матричной 'минус'-цепи
В экстрактах клеток Е. coli, зараженных фагом f2, был обнаружен фагоспецифичный фермент РНК-репликаза. Этот фермент оказался способным осуществлять синтез "плюс"- и "минус"-цепей фаговой РНК in vitro в реакционной смеси, содержащей фаговую РНК-матрицу и четыре рибонуклеозидтрифосфата (АТФ, ГТФ, УТФ и ЦТФ).
В 1965 г. И. Харуна и С. Спигельман очистили от нуклеаз ферментный комплекс РНК-репликазы, выделенный ими из экстрактов клеток Е. coli, зараженных фагом Qβ (этот фаг близок фагу f2), что позволило им наблюдать репликацию вирусной РНК in vitro. Вновь синтезированная РНК была не только идентична родительской РНК по физическим и химическим свойствам, но и обладала инфекционностью. Проникнув в клетку, она вызывала образование в ней интактных инфекционных частиц фага Qβ. Эти исследования позволили понять механизмы репликации РНК-содержащих вирусов растений и животных.
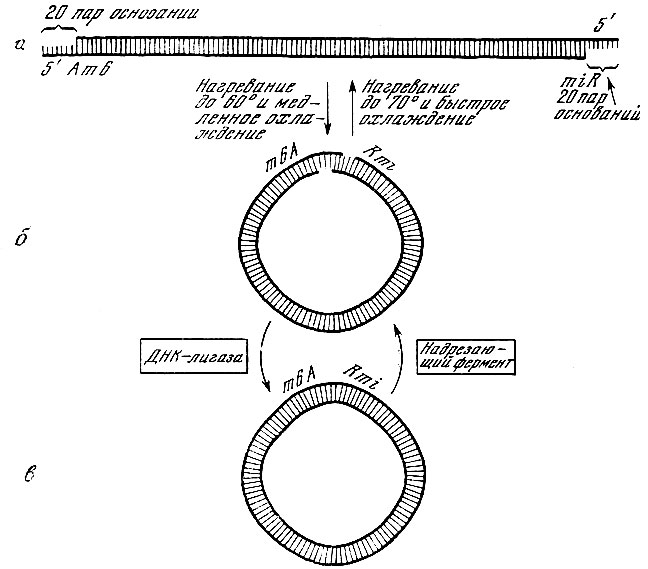
Образование кольцевой формы и 'липких концов' ДНК фага λ (по Э. Кэмпбеллу, 1969): а - хромосома инфекционной частицы фага λ. Слева находится ген А, справа - ген R; б - при нагревании раствора ДНК фага до 60° и медленном охлаждении 'липкие концы' соединяются друг с другом. При нагревании до 70° 'липкие концы' плавятся, и быстрое охлаждение восстанавливает линейную структуру молекулы ДНК фага λ; в - в зоне соединения 'липких концов' имеется разрыв в двойной спирали ДНК, который 'сшивает' фермент ДНК-лигаза. При вхождении колец дочерней ДНК в головку фага-потомка специальный 'надрезающий фермент' делает разрыв в каждой цепи; в результате образуется линейная хромосома с 'липкими концами'
В 50-х годах тщательному изучению подвергся фаг λ. Во многих отношениях он оказался сходным с Т-четными фагами. Частица его состоит из головки и длинного отростка. По составу ДНК фаг λ также близок Т-четным фагам (в его ДНК не содержится только гликолизированного оксиметилцитозина). Наибольший интерес представляет открытие "липких концов"- одноцепочечных участков длиной в 20 нуклеотидов на каждом из 5'-концов ДНК фага λ (А. Херши, Е. Буржи, Л. Ингрем, 1963). Эти участки комплементарны и поэтому позволяют молекуле ДНК свертываться в кольцо. ДНК внутриклеточного фага представляет собой замкнутое ковалентной связью кольцо, образованное путем "скрепления" липких концов (Е. Янг, Р. Синсхеймер, 1964). В 1967 г. P. Bу и А. Кайзер расшифровали нуклеотидную последовательность липких концов фага λ. При созревании фаговых частиц кольцевая вегетативная ДНК "перекусывается" ферментом по двум специфическим межнуклеотидным связям в разных полинуклеотидных цепях, что восстанавливает линейную структуру ДИК с липкими концами, которая и служит хромосомой для дочерних инфекционных фаговых частиц.
В 1961 г. Э. Кэмпбелл выделил большое число условно-летальных мутантов фага λ (мутации могут располагаться в разных частях хромосомы). Скрещивая их между собой, а также другие выделенные к этому времени мутанты фага λ, Кэмпбелл построил генетическую карту фага λ на которой ему удалось идентифицировать 18 генов. Он показал что гены от А до F ответственны за синтез белка фагового отростка, гены от G до J - за формирование головки, ген R - за синтез лизоцима. Все эти гены в отличие от гена N, контролирующего репликацию ДНК относятся к "поздним генам".
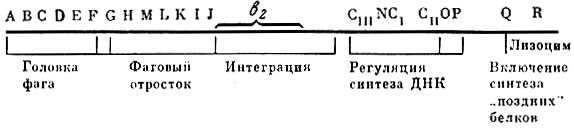
Генетическая карта вегетативного фага λ (по Э. Кэмпбеллу, 1961). Гены A - R необходимы для воспроизводства фага в продуктивном цикле. Гены СI СII и CIII связаны с репрессией продуктивного цикла
Как показали в 1967 г. К. Тейлор, 3. Храдечна и В. Шибальски, разные гены транскрибируются с одного или другого конца цепи, и транскрипция может идти в противоположных направлениях. В 1969 г Шибальски установил, что обе цепи ДНК фага λ являются генетически активными. В 1954 г. Ф. Жакоб и Е. Вольман при скрещивании лизогенных мутантов Hfr с нелизогенной бактерией-реципиентом F' установили так называемое явление зиготной индукции профага. Ее не наблюдалось в случае, когда бактерия-реципиент была лизогенной. На этом основании Г. Бертани(1958) сделал заключение, что зиготная индукция определяется свойствами цитоплазмы клетки-реципиента и что иммунитет лизогенных бактерий к гомологичному умеренному фагу контролируется цитоплазматическим фактором (веществом "иммунности"). В 1957 г А. Кайзер открыл у фага λ с-мутанты (от англ. слова clear), утратившие лизогенность и поэтому образующие прозрачные стерильные пятна (умеренные фаги образуют мутные стерильные пятна из-за вторичного роста лизогенизированных бактерий). Эти мутанты сыграли важную роль в выяснении механизма лизогении. Кайзер скрестил большое число с-мутантов с другими мутантами по типу стерильных пятен и установил, что все с-мутации расположены в одной области генетической карты фага С, определяющей иммунитет. Он показал, что с-мутации распределяются по трем генам - CI, СII и СIII. Способность лизогенизировать чувствительные клетки в первую очередь контролируется геном СI. Мутация CI блокирует цепь реакций, приводящих к превращению генома фага в профаг. При смешанном заражении чувствительных бактерий фагами λ дикого типа (λс+) и их мутантом CI (λCI) удавалось выделить лизогенные клоны, содержащие оба профага (λс+ и λСI). Из этого следует что ген с+ доминирует над CI и что мутанты гена CI имеют какой-то дефект, из-за которого нарушен синтез специфического иммунного репрессора. В 1961 г. Жакоб и Моно предположили, что лизогения является примером регуляции активности гена под действием репрессора. Согласно их взгляду, умеренный фаг продуцирует репрессор, специфически блокирующий функции ранних генов этого фага. Поскольку поздние гены могут функционировать только в присутствии некоторых соединений, контролируемых ранними генами, индукция профага возможна только при разрушении репрессора под действием ультрафиолетовых лучей. Эта гипотеза получила экспериментальное подтверждение. Репрессор фага λ, как показали М. Пташне (1967) и В. Пирота и М. Пташне (1969), является белком, способным in vitro присоединяться к двум операторам (0L, OR), расположенным на генетической карте фага λ в области иммунитета. Мутации в этих операторах снижают их сродство к репрессорам и позволяют функционировать оперонам, считывающимся в противоположных направлениях, начиная с промоторов PL и PR. Считывающийся влево оперон включает ген N, другой содержит гены, необходимые для репликации ДНК и регуляции синтеза репрессора. Репрессия этих двух оперонов продуктом гена CI предотвращает активность всех генов литического фага, поскольку продукт гена CI требует проявления активности гена Q, который в свою очередь нуждается в транскрипции поздних генов (Н. Хопкинс, 1970; Б. Батлер, X. Эколс, 1970) (см. главу 24). Таким образом, фаг λ явился первым биологическим объектом, у которого были раскрыты механизмы регуляции активности генов, определяющие его развитие.
Гипотеза Львова о включении профага в хромосому клетки-хозяина была подтверждена многочисленными данными. Скрещивая лизогенные и нелизогенные клоны Е. coli K12, Е. Л. Вольман (1953) и П. Фредерик (1954) выявили у рекомбинантов расщепление по признаку лизогенности, показав тем самым, что профаг λ ведет себя как ген бактерий. В 1954 г. Р. Эпплярд, скрещивая два родительских штамма Е. coli K12, лизогенных по разным мутантам фага λ, доказал, что генетическим детерминантом лизогенности является сам профаг и что он локализован рядом с геном gal4. Локализация профага на хромосоме бактерии была установлена независимо с помощью мутантов Hfr, передающих при конъюгации с бактерией-реципиентом свою хромосому строго ориентированно, начиная с определенного конца (Е. Л. Вольман, Ф. Жакоб, 1954). Профаг λ поступал в зиготу сразу после локуса gal, но перед локусом trp, что указывало на расположение профага между этими локусами. В 1961 г. Г. Келленбергер, М. Зичичи и Дж. Уйгл нашли, что фаг λ с делецией b2 не способен включаться в хромосому бактерий, но может вызывать продуктивную реакцию. Они показали, что область b2 участвует в генетическом обмене между хромосомой фага λ и участком хромосомы бактерии между генами gal и trp. Этот участок получил название локуса прикрепления (локус attλ). Мутанты фага λ, не имеющие локуса b2, не могут включиться в хромосому бактерий. В 1962 г. Э. Кэмпбелл предложил модель физического включения (интеграции) хромосомы фага в хромосому клетки-хозяина. Между областью b2 хромосомы фага λ, замкнутой в кольцо, и локусом attλ, бактериальной хромосомы происходит синапс. Затем хромосома фага разрывается между генами h и с (в области b2), а хромосома бактерии - между генами gal и trp, после чего гетерологические участки воссоединяются. В результате кроссинговера образуется одна непрерывная генетическая структура с геномом фага λ между генами gal и trp. Таким образом, генетическая карта профага представляет собой перестановку карты вегетативного фага. Модель интеграции профага, предложенная Кэмпбеллом, была подтверждена генетически (Р. Ротман, 1965).
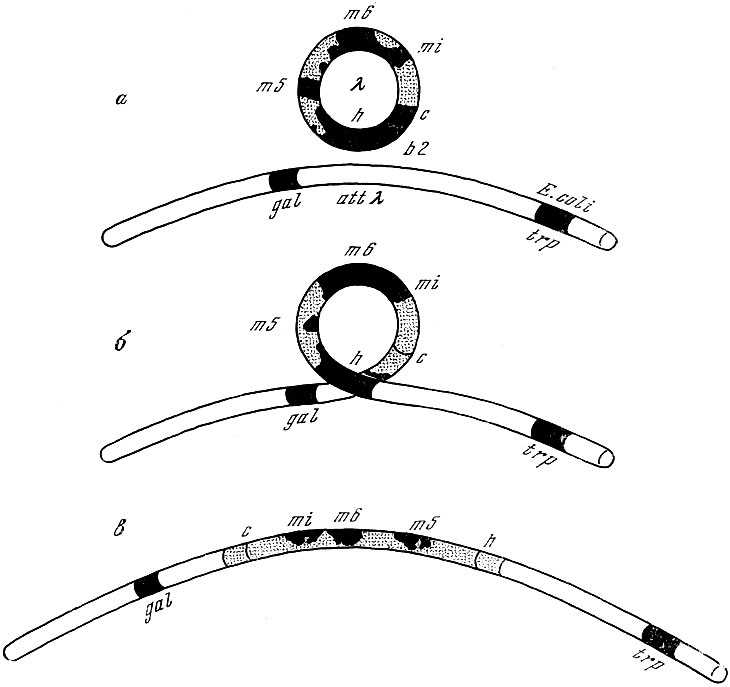
Модель Кэмпбелла (1962) интеграции профага: а - кольцевая хромосома фага образует синапс с местом прикрепления фага λ(attλ) на хромосоме бактерии; б - хромосома фага разрывается между генами h и c (в области b2, а хромосома бактерии разрывается между генами gal и trp; в - в результате кроссинговера образуется одна непрерывная генетическая структура, содержащая геном фага между генами gal и trp
Исследования лизогении и транcдукции, показавшие изменения свойств клетки-хозяина в результате физического включения в хромосому клетки генома умеренных лизогенирующих и трансдуцирующих фагов, навели на мысль, что вирусный канцерогенез также может быть связан с включением генома онкогенного вируса в хромосому клетки (Р. Дюльбекко, 1960; Л. А. Зильбер, 1961). Это привело к интенсивным исследованиям в последние годы онкогенных ДНК- и РНКсодержащих вирусов.
Изучение вирусов животных и человека. (Э. Р. Пилле)
После того как Д. И. Ивановский установил способность ВТМ проходить через фильтры, задерживающие бактерии, началось изучение в том же плане возбудителей различных болезней животных и человека. Уже в 1898 г. Ф. Лефлер и П. Фрош сообщили о фильтруемости вируса ящура. Путем количественного определения вируса они показали его способность размножаться в пораженном организме. В течение нескольких последующих лет была установлена фильтруемость возбудителей чумы кур, желтой лихорадки и чумы свиней.
Поскольку большинство вирусов увидеть при помощи светового микроскопа нельзя, усилия ученых на первых этапах были направлены на изучение более крупных образований, которые формируют некоторые вирусы в пораженных клетках. Подобные включения Оыли описаны еще в XIX в. при контагиозном моллюске человека, при оспе птиц (О. Боллингер) и при оспе человека (Г. Гварниери). В 1903 г. А. Негри описал своеобразные тельца, выявляемые в протоплазме нервных клеток при бешенстве. В 1921 г. Б. Липшютц классифицировал вирусные включения по их местоположению в ядре или цитоплазме клетки. Вирусы оспы и бешенства, например, формируют включения в цитоплазме, аденовирусы и герпетические вирусы - в ядре, а вирус кори - в ядре и цитоплазме. Было установлено, что включения различаются по своей структуре. Они могут представлять собой места синтеза вирусных компонентов (оспенные вирусы), агрегаты вирусных частиц (аденовирусы) или являться следствием нарушенного клеточного обмена (при герпетической инфекции.
Впервые непосредственно вирусные частицы удалось увидеть Дж. Буисту в 1887 г. при исследовании материала от оспенного больного; возбудитель оспы относится к наиболее крупным вирусам, размеры которого находятся на границе разрешающей способности светового микроскопа.
До 1931 г. выделение и культивирование вирусов человека и животных осуществлялось почти исключительно путем заражения восприимчивых животных. Имелись отдельные успешные попытки размножения вирусов в клеточных культурах (осповакцины, ящура), однако ввиду сложности техники они не нашли сколько-нибудь широкого применения.
Путем заражения животных были изолированы и изучены возбудители оспы, бешенства, простого герпеса, гриппа, полиомиелита, лимфоцитарного хориоменингита, желтой лихорадки, ряда клещевых и комариных энцефалитов, энцефаломиелитов лошадей и некоторые другие. Однако этот метод не позволял получать вирус в больших количествах, необходимых для его детального изучения; к тому же большие трудности представляла очистка материала от тканевых фрагментов. Кроме того, далеко не все вирусные инфекции удавалось воспроизвести на лабораторных животных.
Толчком для дальнейшего развития вирусологии послужило открытие в 1931 г. А. Вудраффом и Е. Гудпасчуром возможности культивировать вирус оспы кур в развивающемся курином эмбрионе. Было установлено, что очень многие вирусы хорошо размножаются в этих условиях, накапливаясь в хорионаллантоисной оболочке и жидкостях эмбриона. Очистка вируса от аллантоисной жидкости оказалась сравнительно простой. К тому же у некоторых вирусов (например, ряда представителей оспенной группы) была обнаружена способность вызывать на хорионаллантоисной оболочке очаговые поражения, по числу которых можно весьма точно определить титр вируса.
В 1941 г. Г. К. Херст обнаружил у вируса гриппа способность склеивать эритроциты кур. В дальнейшем у многих вирусов была установлена способность агглютинировать эритроциты тех или иных млекопитающих и птиц. Это дало в руки вирусологов простой метод количественного определения многих вирусов и соответствующих антител.
В 30-е годы были разработаны новые методы исследования вирусов. В 1939 г. М. фон Арденн и X. Руска предложили метод электронно-микроскопического исследования вирусных частиц, находящихся во взвеси. Позже была разработана методика получения ультратонких тканевых срезов, позволяющая исследовать электронномикроскопически вирусы внутри пораженных клеток. Для получения концентрированных вирусных суспензий стали использовать центрифугирование при большом числе оборотов. Путем измерения скорости осаждения различных вирусов оказалось возможным определить их размеры и вес. В 1933 г. У. Дж. Элфорд предложил использовать для определения размеров вирусов коллодийные мембраны с различной величиной пор. После получения ВТМ в кристаллическом виде было установлено, что формировать кристаллические структуры могут и некоторые мелкие вирусы позвоночных, например вирус полиомиелита.
Совершенно исключительное значение для развития вирусологии имела предложенная в 1949 г. Дж. Эндерсом, Т. Уэллером и Ф. Роббинсом методика получения однослойных клеточных культур из обработанных трипсином тканей. Она позволяет выращивать практически любые типы клеток. Выращенные в культуре клетки нередко обладают значительно более широким спектром восприимчивости по отношению к различным вирусам, чем те же клетки в организме. При инокуляции достаточной дозы вируса оказалось возможным инфицировать одновременно все клетки однослойной культуры. Это позволило получать вирус в высоком титре, к тому же с небольшой примесью клеточных белков. Большинство вирусов при развитии в однослойных культурах вызывает дегенерацию клеток ("цитопатический эффект"). Это явление стали широко использовать для титрования вирусов и антител.
Р. Дюльбекко и М. Фогт (1952) разработали на основе однослойных клеточных культур методику получения под слоем агара или другого геля колоний вируса (бляшек), образующихся из одной инфекционной вирусной частицы. Метод позволил производить точный подсчет количества инфекционных вирусных частиц, а также выделять отдельные клоны вируса, что необходимо при генетических и иных исследованиях.
Размеры вирусов животных и человека находятся в пределах от 300 нм (оспенные вирусы) до 18 - 22 нм (адено-ассоциированные). Использование электронной микроскопии и рентгеноструктурного анализа в сочетании с рядом других методов позволило в течение последних двух десятилетий расшифровать структуру большинства вирусов. Начало этим исследованиям положили Ф. Крик и Дж. Уотсон в 1956 г. Было установлено, что все вирусы человека и животных состоят из ядра, содержащего один тип нуклеиновой кислоты - ДНК или РНК, и протеиновой оболочки (капсида). Вместе обе эти структуры носят название нуклеокапсида. Капсид любого вируса построен из структурных субъединиц, каждая из которых представляет одну или несколько полипептидных цепей. Существует два типа организации субъединиц - спиральный и кубический. У некоторых крупных вирусов (например, оспенных) могут комбинироваться оба способа соединения субъединиц. При спиральной структуре нуклеокапсид имеет форму тяжа (например, у вируса гриппа), а при кубической - правильного многогранника (например, у аденовирусов).
Мелкие вирусы (например, вирус полиомиелита) представляют собой "голый" нуклеокапсид. Более крупные вирусы (герпетические, миксовирусы) имеют еще внешнюю оболочку, которая у ряда вирусов состоит в основном из материала клетки и содержит протеины, углеводы и иногда липоиды.
Большинство РНКсодержащих вирусов животных и человека содержит одну молекулу одноцепочечной РНК. Исключение составляют реовирусы и группа орбивирусов, у которых РНК состоит из двух комплементарных цепей. У большинства ДНКсодержащих вирусов нуклеиновая кислота представляет собой двухцепочечную молекулу и только одна группа вирусов (парвовирусы) имеют одноцепочечную ДНК. Величина информации, заключенной в нуклеиновой кислоте разных вирусов, различна и зависит от длины тяжа нуклеиновой кислоты. Мелкие вирусы могут синтезировать небольшое число протеинов, более сложные - помимо структурных протеинов еще ферменты. Некоторые вирусы (например, адено-ассоциированные) обладают, по-видимому, недостаточной информацией даже для собственного воспроизводства: для своего размножения они нуждаются в аденовирусе-помощнике.
Для изучения процессов репликации вирусов животных и человека и взаимодействия их с клетками большое значение имел разработанный А. Кунсом (1941) метод окраски вирусных антител флюорохромами, например флюоресцеин-изотиоцианатом, который позволяет изучать при помощи люминесцентной микроскопии динамику накопления вирусных белков в клетке. На том же принципе основано использование конъюгированных с ферритином или пероксидазой антител, когда вирусные антитела в клетке выявляют при помощи электронной микроскопии.
Адсорбция вирусов животных на клетках происходит в результате действия электростатических сил, межмолекулярных сил Ван-дер-Ваальса, а также взаимодействия соответствующих друг другу рецепторов вируса и клетки. Есть вирусы (например, пикорнавирусы), адсорбирующиеся только на восприимчивых клетках; другие (оспенные и аденовирусы) могут соединяться как с восприимчивыми, так и невосприимчивыми клетками. Некоторые клетки, не обладающие рецепторами для взаимодействия с какими-либо вирусами in vivo, приобретают их при культивировании in vitro (почечные клетки приматов к вирусу полиомиелита).
В отличие от бактериофагов вирусы животных не обладают каким-либо сложным аппаратом для введения в клетку своей нуклеиновой кислоты; они просто фагоцитируются клеткой. Некоторые вирусы (например, полиомиелита) уже при адсорбции на клетке теряют свой капсид. Другие (герпетические и оспенные вирусы, миксо- и аденовирусы) проникают в клетку в виде цельных вирионов и уже там нуклеиновая кислота освобождается из капсида.
Было выяснено, что процесс репликации отдельных вирусов человека и животных имеет определенные особенности, однако у всех она протекает по общей принципиальной схеме. Репликация начинается с синтеза "ранних протеинов", которые служат для репликации нуклеиновой кислоты, но не включаются в вирусные частицы. Лишь после этого начинается процесс репликации самой нуклеиновой кислоты.
Что касается процесса синтеза структурных белков, входящих в состав вируса, то оказалось, что он протекает несколько отлично у ДНК-и РНКсодержащих вирусов. Для передачи информации у первых на одном из тяжей ДНК после их расхождения концентрируются рибонуклеотиды, из которых синтезируется РНК (информационная РНК), передающая информацию от ДНК клеточным рибосомам, где происходит синтез вирусных белков. У РНКсодержащих вирусов функция передачи информации принадлежит самой вирусной РНК.
Места синтеза вирусных компонентов в клетке у разных вирусов различны. У оспенных вирусов весь процесс протекает в цитоплазме, у аденовирусов - в ядре, в то время как ДНК герпетических вирусов синтезируется в ядре, а структурные белки в цитоплазме. Созревание всех вирусов, т. е. соединение нуклеиновой кислоты и белков, происходит в цитоплазме, очевидно, по типу кристаллизации.
Внешнюю оболочку вирусы приобретают при прохождении через различные клеточные мембраны. Свернутый в клубок нитевидный нуклеокапсид вируса гриппа и других микровирусов облекается оболочкой в момент прохождения через оболочку клетки. Герпетические вирусы приобретают оболочки при прохождении как сквозь ядерные, так и цитоплазматические мембраны.
В 1946 г. П. фон Магнус представил доказательства того, что при заражении куриных эмбрионов большой дозой вируса гриппа наряду с полноценными вирусными частицами возникали неполные, которые обладали гемагглютинирующей активностью, но не были инфекционны. Позже было установлено, что в неполных частицах резко редуцировано количество нуклеиновой кислоты. В дальнейшем неполные частицы были найдены в культурах многих вирусов. Причины их возникновения могут быть различны; механизм этого явления во многом остается еще неясным.
Были описаны различные формы взаимодействия вирусных частиц, находящихся в одной клетке. Г. Берри и X. Дедрик (1936) наблюдали реактивацию гретого вируса миксомы, если его вводили кролику одновременно с инфекционным вирусом фибромы. Позже было установлено, что в этом случае активный вирус освобождает нуклеиновую кислоту гретого вируса из капсида, вследствие чего она приобретает способность функционировать. При генетической форме реактивации соединяются два или более поврежденных геномов одного вируса.
В 1953 г. Г. К. Херст и Т. Готлиб наблюдали фенотипическое смешивание двух штаммов вируса гриппа с образованием нестойких вариантов. В 1956 г. они описали рекомбинацию двух гриппозных штаммов с появлением генетически стойких вариантов со свойствами обоих родителей. В 1964 г. У. П. Pay и С. Г. Баум, а также Р. Хьюбнер с сотрудниками обнаружили образование гибридов между неродственными вирусами - аденовирусом человека и вакуолизирующим вирусом обезьян.
Комплементация у вирусов животных наблюдается при размножении дефектных штаммов вируса саркомы Рауса кур, которые приобретают капсид лишь при помощи некоторых других представителей группы лейковирусов (X. Ханафуза и сотр., 1963). Адено-ассоциированные вирусы, относящиеся к парвовирусам, нуждаются для своей репликации в "помощнике" из иной группы - аденовирусе.
Упомянутое выше цитопатическое действие вируса представляет собой гибель инфицированных клеток вследствие резкого нарушения метаболизма. Далее было установлено, что некоторые вирусы, например возбудитель лимфоцитарного хориоменингита, могут размножаться в клетках без нарушения их структуры.
Принципиально отличной формой взаимодействия вирусов и клеток является трансформация клеток, связанная с онкогенной активностью вирусов. Еще в 1908 г. В. Эллерман и О. Банг установили, что висцеральный лимфоматоз кур можно пассировать бесклеточным материалом. В 1911 г. П. Раус перевил саркому кур бесклеточным фильтратом. В 1936 г. Дж. Битнер открыл вирус рака молочных желез мышей. Большое значение для изучения онкогенных вирусов имела описанная Р. А. Менекером и В. Гроупом (1956) трансформация культуры фибробластов куриного эмбриона под действием вируса саркомы Рауса, когда они приобретали способность к непрерывному росту и делению, как при опухолевом процессе в организме. Затем способность вызывать трансформацию клеток in vitro была обнаружена также у ДНКсодержащих онкогенных вирусов - полиомы, SV40 обезьян, аденовирусов.
Все онкогенные РНКсодержащие вирусы относятся к одной группе - лейковирусам, в то время как ДНКсодержащие - к различным группам - оспенным вирусам, папова, аденовирусам и герпетическим. Общим свойством обеих групп является способность интегрировать свой геном в геном клетки, вследствие чего она приобретает способность к неограниченному росту. Эта концепция была выдвинута Р. Дюльбекко (1960) и Л. А. Зильбером (1961). Было установлено, что трансформированные ДНКсодержащими вирусами клетки содержат часть вирусного генома, синтезируют вирусспецифический трансплантационный антиген, но не продуцируют вирусных частиц (исключение составляют оспенные вирусы). В отношении РНКсодержащих вирусов X. Темин высказал в 1964 г. предположение (вскоре оно получило подтверждение), что они включают в клеточный геном не РНК, а образованную комплементарную двуспиральную ДНК. У всех лейковирусов был обнаружен необходимый для этого фермент - РНК-зависимая ДНК-полимераза (ревертаза) (Г. Темин, С. Мицетани, 1970). Следует отметить, что большинство онкогенных вирусов могут функционировать и как инфекционные, вызывая дегенерацию клеток.
Одной из реакций клетки на внедрение вируса является выработка резистентности к заражению другим вирусом (явление интерференции). В 1935 г. М. Хоскинс сообщил о взаимном подавляющем действии нейтронного и висцеротропного штаммов вируса лихорадки в опытах на обезьянах, а Ф. Маграсси - двух различных штаммов вируса герпеса простого при введении кроликам. Вскоре интерференция была выявлена и между неродственными вирусами, если опыты ставились с куриными эмбрионами или клеточными культурами. Далее было установлено, что резистентность клетки может вызвать не только живой, но и инактивированный вирус. В большинстве случаев интерференция оказалась связанной с синтезом клеткой особого белка - интерферона, открытого А. Айзаксом и Дж. Линденманном в 1957 г. Интерферон обусловливает невосприимчивость клетки к различным вирусам и отличается видоспецифичностью (так, куриный интерферон защищает только куриные клетки).
Надежды использовать интерферон для лечения вирусных заболеваний не оправдались, хотя он и может применяться как профилактическое средство. Большее значение имеет стимуляция синтеза организмом собственного интерферона; индукторами могут служить определенные химические соединения, например двутяжные РНК.
Наиболее эффективным методом борьбы с вирусными инфекциями остается активная иммунизация. Предложенная Э. Дженнером в 1796 г. вакцина против оспы является одним из лучших противовирусных препаратов. Задолго до открытия вирусов была также разработана Л. Пастером вакцина против бешенства. Очень эффективным препаратом оказалась вакцина против желтой лихорадки, разработанная в 30-е годы XX в. Все эти вакцины готовятся из живого ослабленного вируса.
Большое значение в борьбе с полиомиелитом сыграли разработанная Дж. Солком в начале 50-х годов убитая вакцина, а затем и живые вакцины (X. Копровский, 1952; А. Сэбин, 1957). Массовое распространение получила также вакцина против кори. Очень сложным оказалось создание эффективной вакцины против гриппа вследствие перманентной изменчивости циркулирующих в природе вирусов ("антигенный дрейф").
Химиотерапия вирусных инфекций достигла некоторых успехов лишь в последнее десятилетие. Так, 1-адамантанамингидрохлорид действует на первые стадии репродукции вирусов гриппа, парагриппа и краснухи. При оспенном и герпетическом поражении роговицы используют 2-иод-2'-дезоксиуридин, блокирующий синтез вирусной ДНК. Метисазон (из группы теосемикарбазонов) оказался весьма эффективным в отношении оспенной инфекции, подавляя синтез структурных белков вируса.
* * *
Вирусные заболевания обнаружены практически у всех живых существ - млекопитающих, птиц, пресмыкающихся, земноводных, насекомых, растений, бактерий, микоплазм и др. Хотя первая вакцина против вирусного заболевания - оспы - была предложена еще в XVIII в. Дженнером, а вакцина против бешенства разработана в XIX в. Пастером, основоположником вирусологии по праву считается Ивановский, установивший в 1892 г., что возбудитель табачной мозаики проходит через фильтры, задерживающие бактерии, т. е. имеет очень малые размеры. В 1898 г. М. В. Бейеринк показал, что размножение этого агента начинается лишь после его внедрения в цитоплазму клеток растения.
В течение последующих трех десятилетий был открыт целый ряд вирусов животных и человека, разработаны методы их культивирования в организме животных и в куриных эмбрионах. В 1935 г. У. Стенли очистил и получил в кристаллическом виде ВТМ. Было доказано, что он является нуклеопротеидом.
Изучение вирусов показало, что они представляют собой совершенно особую форму органической материи и отличаются как от животных, так и от растений. Поскольку вирусы относятся к наиболее просто организованным организмам, они были использованы в качестве модели для решения ряда фундаментальных проблем биологии. Самые крупные открытия были сделаны при изучении бактериофагов, впервые описанных в 1915 г. Ф. Туортом. Разработанный Э. Эллисом и М. Дельбрюком метод одиночного цикла размножения фагов лег в основу количественных методов их исследования.
В 1948-1949 гг. А. Херши и Р. Ротман построили первую генетическую карту фага Т2. Открытие трансдукции - способности фага переносить генетическую информацию от одной бактерии к другой - позволило составить генетические карты бактерий. В 1952 г. А. Херши и М. Чейз показали, что для репродукции фага достаточно проникновения в бактериальную клетку его ДНК, которая является носителем генетической информации. В 1956 г. А. Гирер и Г. Шрамм, а также X. Френкель-Конрат установили, что у РНКсодержащего ВТМ генетические функции несет РНК. Оказалось, что в вирусных нуклеиновых кислотах содержится информация как собственной репликации, так и синтеза белков капсида. Дальнейшее изучение фагов позволило Ф. Крику (1953) раскрыть генетический код. С возникновением молекулярной биологии вирусология стала ее составной частью, поскольку вирусы представляют собой субклеточные объекты макромолекулярного уровня.
Многие методы работы с фагами и возникшие при этом концепции были затем использованы для изучения вирусов растений и животных. Особенно важное значение для работы с вирусами животных и человека имел предложенный Дж. Эндерсом (1949) способ их выращивания в однослойных клеточных культурах, а также метод точного количественного определения инфекционных вирусных частиц, разработанный Р. Дюльбекко и М. Фогт. Изучение структуры вирусов показало, что все они построены по общему принципиальному плану и состоят из нуклеиновой кислоты (ДНК или РНК) в одно - или двухцепочечной форме и окружающей ее протеиновой оболочки из отдельных субъединиц; последние расположены по спирали или образуют правильный многогранник. Наиболее сложное строение имеют фаги, состоящие из головки и отростка с чехлом и нитями. Вирусы растений представляют собой образования палочковидной или сферической формы. Вирусы животных и человека обладают сферической или близкой к ней формой. Некоторые из них снабжены внешней оболочкой, состоящей из белков, углеводов и иногда липоидов.
Изучение процессов взаимодействия вирусов и клеток показало, что чаще всего вирус вызывает инфекционный процесс, приводящий к гибели клетки. Реже размножение вируса в клетке происходит без нарушения ее структуры. Своеобразной оказалась форма взаимодействия с клеткой у вирусов, обладающих онкогенной активностью. ДНКсодержащие онкогенные вирусы внедряют в геном клетки часть своего генома, а РНКсодержащие - образованную при помощи особого фермента - обратной транскриптазы - комплементарную своей РНК двутяжевую ДНК. Это приводит к опухолевой трансформации клетки: она приобретает способность к непрерывному росту и делению.
После того как было установлено единообразие структуры и функции всех вирусов, оказалось возможным разработать их рациональную классификацию. В ее основу были положены физико-химические свойства вирусных частиц - их размеры, вид входящей в их состав нуклеиновой кислоты, число структурных субъединиц в капсиде, тип симметрии капсида (спиральный, кубический или комплексный), наличие или отсутствие внешней оболочки, место ее формирования (у ядерной, интерцитоплазматических или поверхностной мембран клетки), наличие или отсутствие в ее составе липоидов. В соответствии с этой классификацией производится идентификация вновь выделенных вирусов - определение их родовой и видовой принадлежности.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'