
5.4.3. Связи
Аминокислоты способны образовывать ряд химических связей с различными реакционноспособными группами. Ниже мы убедимся в том, что это их свойство крайне существенно для структуры и функции белков.
Пептидная связь
Эта связь образуется в результате выделения молекулы воды при взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой. Реакция, идущая с выделением воды, называется реакцией конденсации, а возникающая ковалентная азот-углеродная связь - пептидной связью (рис. 5.26). Соединение, образующееся в результате конденсации двух аминокислот, представляет собой дипептид. На одном конце его молекулы находится свободная аминогруппа, а на другом - свободная карбоксильная группа. Благодаря этому дипептид может присоединять к себе другие аминокислоты. Если таким образом соединяется много аминокислот, то образуется полипептид (рис. 5.27).
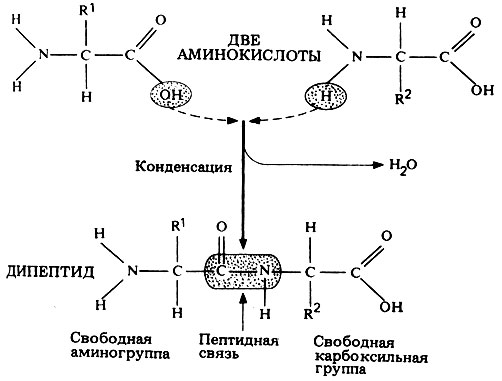
Рис. 5.26. Образование дипептида в результате конденсации двух аминокислот
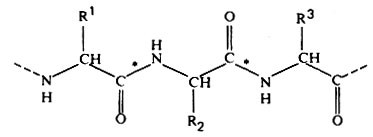
Рис. 5.27. Часть молекулы полипептида, образованная тремя остатками аминокислоты. Пептидные связи обозначены звездочкой
5.16. Напишите структурную формулу трипептида, состоящего из аланина, глицина и серина, соединенных в указанном порядке.
Ионная связь
При подходящем значении рН ионизированная аминогруппа может взаимодействовать с ионизированной карбоксильной группой, в результате чего возникает ионная связь (рис. 5.28). В водной среде ионные связи значительно слабее ковалентных; они могут разрываться при изменении рН среды.
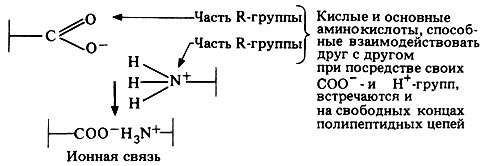
Рис. 5.28. Образование ионной связи
Дисульфидная связь
Когда соединяются две молекулы цистеина, их сульфгидрильные (-SH) группы, оказавшиеся по соседству, окисляются и образуют дисульфидную связь (рис. 5.29). Дисульфидные связи могут возникать как между разными полипептидными цепями, так и между различными участками одной и той же полипептидной цепи. Это обстоятельство играет важную роль в белковой структуре (рис. 5.32 и 5.33).
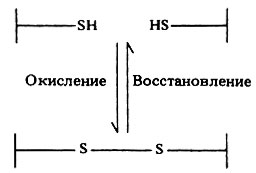
Рис. 5.29. Образование дисульфидной связи
Водородная связь
Электроположительные водородные атомы, соединенные с кислородом или азотом в группах -ОН или -NH, стремятся обобществить электроны с находящимся по соседству электроотрицательным атомом кислорода, например с кислородом группы =СО (рис. 5.30). Образующаяся в результате этого водородная связь слаба, но такие связи возникают очень часто, так что общий их вклад в стабильность молекулярной структуры (например, структуры шелка) весьма значителен (рис. 5.35, А).
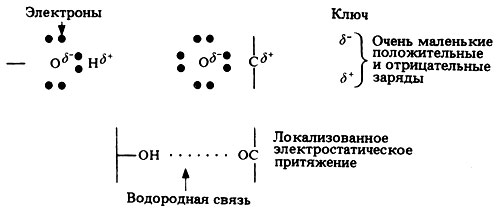
Рис. 5.30. Образование водородной связи
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'