
6.1. Катализ и энергия активации
Биологические катализаторы (т. е. ферменты) характеризуются следующими основными свойствами: все ферменты представляют собой глобулярные белки; они увеличивают скорость реакции, но сами в этой реакции не расходуются; их присутствие не влияет ни на природу, ни на свойства конечного продукта (или продуктов) реакции; очень малое количество фермента вызывает превращение больших количеств субстрата; активность ферментов меняется в зависимости от рН, температуры, давления и от концентраций как субстрата, так и самого фермента; катализируемая реакция обратима; ферменты обладают специфичностью, т. е. один фермент катализирует обычно только одну реакцию.
Представим себе смесь бензина и кислорода. Реакция между этими двумя веществами с термодинамической точки зрения возможна, но она не пойдет без затраты некоторого количества энергии, поступившей, например, в форме простой искры. Энергия, необходимая для того, чтобы заставить субстраты вступить в реакцию, называется энергией активации [Еа]. Чем больше требуемая энергия активации, тем ниже скорость реакции при данной температуре. Ферменты, действуя как катализаторы, снижают энергию активации, которая требуется для того, чтобы могла произойти реакция (рис. 6.1). Они повышают общую скорость реакции, не изменяя в сколько-нибудь значительной степени температуру, при которой эта реакция протекает.
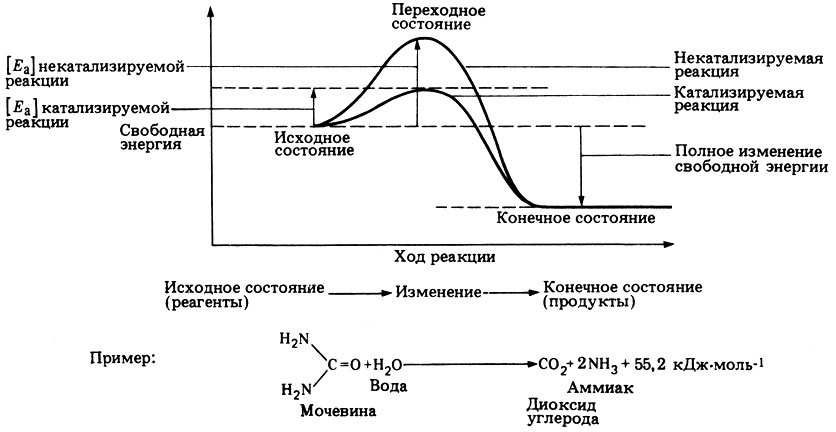
Рис. 6.1. Энергетические барьеры катализируемой и некатализируемой реакций (см. также приложение 1)
Фермент, соединяясь с субстратом, образует короткоживущий фермент-субстратный комплекс (рис. 6.2). В таком комплексе шансы на то, что реакция произойдет, значительно возрастают. По завершении реакции фермент-субстратный комплекс распадается на продукт (или продукты) и фермент. Фермент в реакции не изменяется: по окончании реакции он остается таким же, каким был до нее, и может теперь взаимодействовать с новой молекулой субстрата:

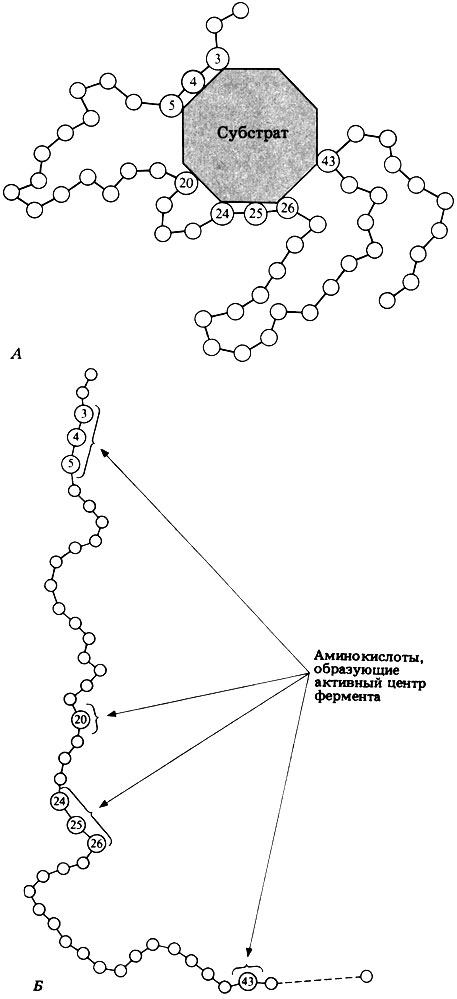
Рис. 6.2. А. Схематическое изображение фермент-субстратного комплекса (субстрат присоединяется к ферменту в активном центре последнего). Б. Положение аминокислотных остатков, образующих активный центр фермента, в первичной структуре ферментного белка
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'