
П.1.1.5. Кислоты, основания, соли, рН и буферы
Атом водорода состоит из одного электрона и одного протона. Если электрон утрачивается, то остается один протон, так что протон можно рассматривать как ион водорода; обычно его обозначают Н+. Кислотой называется вещество, способное служить донором протонов; при диссоциации (диссоциация-разделение на ионы, из которых состоит данное вещество) кислота образует в качестве катиона Н+. В этой книге мы будем пользоваться определением, согласно которому кислота - это вещество, которое, диссоциируя в воде, дает в качестве катиона ионы Н+. Сильной кислотой (примером может служить соляная кислота, НС1) называется кислота, диссоциирующая почти полностью. Сильная кислота является, таким образом, более эффективным донором протонов, нежели слабая кислота, например уксусная или угольная, у которых лишь небольшая часть молекул диссоциирует с образованием ионов Н+:
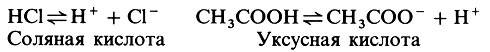
Ниже перечислены характерные свойства кислот.
1. Многие кислоты реагируют с такими реакционноспособными металлами, как цинк или магний, что сопровождается выделением водорода.
2. Кислоты нейтрализуются основаниями, в результате чего образуются соли этих кислот и вода.
3. Почти все кислоты реагируют с карбонатами, что сопровождается выделением диоксида углерода.
4. В разбавленных растворах кислоты имеют кислый вкус, например этановая (уксусная) кислота.
5. Растворы кислот дают характерное окрашивание с индикаторами; например, синяя лакмусовая бумага окрашивается под. действием кислоты в красный цвет.
Основанием называется вещество, которое реагирует с кислотой, образуя соль и воду (по-другому основание можно определить как вещество, способное служить акцептором протонов). Большинство оснований в воде не растворяется. Растворимые основания дают растворы, которые называются щелочами. К ним относятся, например, гидроксид натрия, гидроксид кальция и гидроксид аммония. Ниже перечислены другие характерные свойства оснований.
1. Основания обычно плохо взаимодействуют с металлами.
2. Основания реагируют с водными растворами солей большинства металлов; при этом в осадок выпадает нерастворимый гидроксид.
3. При реакции оснований с солями аммония выделяется аммиак.
4. Растворы оснований дают характерное окрашивание с индикаторами; например, красная лакмусовая бумага окрашивается под действием оснований в синий цвет.
Соль - это соединение, образующееся в результате полного или частичного замещения атомов водорода кислоты металлом. Примером может служить хлорид натрия, в котором атом водорода хлористоводородной (соляной) кислоты замещен атомом натрия. При растворении соли в воде составляющие ее ионы диссоциируют, т. е. превращаются в свободные ионы, отделенные друг от друга молекулами воды.
Шкала рН
Кислотность или щелочность раствора определяется концентрацией ионов водорода в этом растворе. Эту концентрацию выражают через рН раствора (р указывает на определенную математическую операцию; Н - символ водорода); рН есть десятичный логарифм величины, обратной концентрации ионов водорода. В одном кубическом дециметре (1 л) чистой воды содержится 1·10-7 моль ионов водорода. Следовательно, для воды величина рН равна log(l/107)=7.
Эта величина (рН 7,0) характеризует нейтральный раствор (при комнатной температуре). Значения ниже 7,0 указывают на кислый раствор, а выше 7,0 - на щелочной.
Шкала рН охватывает пределы приблизительно от -1 до 15 (по большей части 0-14). Это логарифмическая шкала, так что изменение на одну единицу рН соответствует десятикратному изменению концентрации ионов водорода.
Для клеток и тканей требуется рН около 7,0 и отклонения от этой величины более чем на одну или две единицы сказываются на них губительно. Следовательно, для поддержания рН жидкостей тела на более или менее постоянном уровне существуют определенные механизмы. Частично это достигается при помощи буферов.
Буферы
Буферный раствор - это раствор, содержащий смесь какой-либо слабой кислоты и ее растворимой соли. Действие его заключается в том, чтобы противостоять изменениям рН. Такого рода изменения могут возникать вследствие разбавления, а также при добавлении кислоты или соли.
Когда кислотность (концентрация ионов водорода) возрастает, свободные анионы, источником которых служит соль, легче соединяются со свободными ионами водорода и удаляют их из раствора. Когда кислотность снижается, усиливается тенденция к высвобождению ионов водорода. Таким образом, буферный раствор поддерживает постоянную, сбалансированную концентрацию ионов водорода. Поясним это на примере:
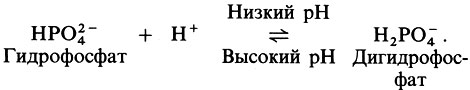
Некоторые органические соединения, в частности белки, способны действовать как буферы; это их качество особенно важно для крови.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'