
П.2.5. Электронный микроскоп
Разрешающая способность светового микроскопа ограничена длиной световых волн. Максимально возможное разрешение равно половине длины волны используемого света. Получить изображение объекта размером меньше, чем эта величина, невозможно. Средняя длина волны видимого света составляет примерно 550 нм, поэтому в конце XIX в. могли получить разрешение примерно в 200 нм. Незначительное увеличение разрешающей способности было достигнуто благодаря использованию специально сконструированного микроскопа с ультрафиолетовым светом (длина волны которого составляет 250 нм), обеспечивающим разрешение примерно в 100 нм. Однако многие клеточные структуры имеют меньший размер. Эта проблема была решена в тридцатые - сороковые годы, когда создание электронного микроскопа произвело революцию в биологической науке. Вместо светового излучения в электронном микроскопе используют пучок электронов, у которых длина волны значительно меньше и, следовательно, с намного большей разрешающей способностью. Длина волны электронов зависит от напряжения, подаваемого для генерации электронного пучка, но практически можно получить разрешение приблизительно в 0,5 нм, т. е. примерно в 500 раз больше, чем в световом микроскопе. Создаваемое увеличение достаточно, чтобы различить крупные молекулы. Лимитирующим фактором в достижении большего увеличения стало (и остается до сих пор) не усиление разрешающей способности микроскопа, а методы подготовки материала для исследования.
В сущности принцип действия электронного микроскопа такой же, как и светового микроскопа, в котором пучок световых лучей направляется линзой конденсора через образец, а полученное изображение затем, увеличивается с помощью линз. В табл. П.2.4 суммированы некоторые сходства и различия между этими микроскопами. Запомните также, что принципы подготовки материала для электронной и световой микроскопии примерно одинаковы, хотя имеются и важные различия (табл. П.2.3).
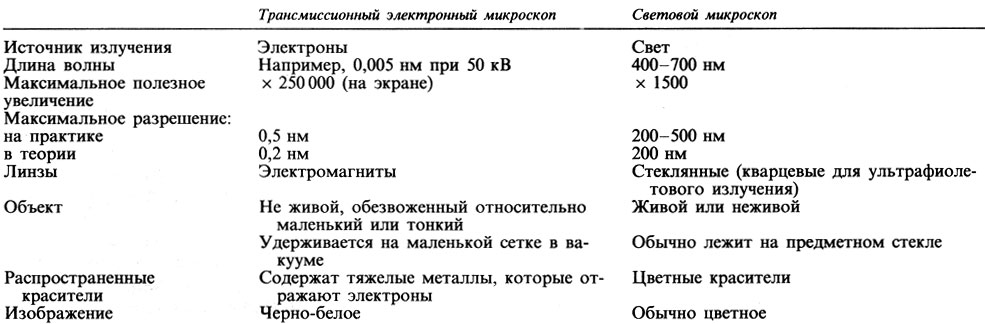
Таблица П.2.4. Сравнение светового и электронного микроскопов
Оператор сидит у пульта управления лицом к колонне, по которой проходит пучок электронов (рис. П.2.5). Электронный микроскоп перевернут "вверх дном" по сравнению со световым микроскопом. Здесь источник электронов находится в верхней части колонны, а сам образец - внизу (рис. П.2.6). На вольфрамовую нить накала, находящуюся в верхней части колонны, подается высокое напряжение (например 50000 В), и нить накала излучает поток электронов. Чтобы сфокусировать эти электроны (изменить их траекторию), необходимы уже не стеклянные линзы, а электромагниты. Внутри колонны создается глубокий вакуум, чтобы сократить до минимума рассеивание электронов из-за столкновения с частицами воздуха и происходящее в результате этого нагревание. В трансмиссионном (просвечивающем) электронном микроскопе электроны проходят через образец, поэтому для изучения можно использовать только очень тонкие срезы или частицы, так как электроны легко рассеиваются или поглощаются исследуемым объектом. Части образца с относительно высокой молекулярной массой в наибольшей степени вызывают рассеивание электронов, поэтому при окрашивании образца с целью увеличения контраста используются тяжелые металлы, такие, как свинец или уран. Образец обычно удерживается на маленькой медной сетке (примерно 2 мм в диаметре), которую иногда для большей прочности покрывают тонкой пластмассовой пленкой. Пройдя через образец, электроны собираются и фокусируются добавочными электромагнитными линзами. Электроны невидимы для человеческого глаза, поэтому они направляются или на флуоресцентный экран, который воспроизводит видимое изображение, или же непосредственно на фотопленку, чтобы получить постоянный фотоснимок (электронную микрофотографию).

Рис. П.2.5. Современный трансмиссионный электронный микроскоп
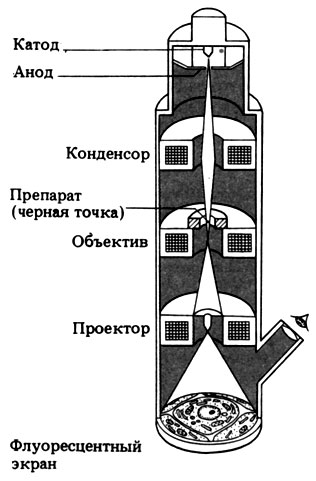
Рис. П.2.6. Траектория пучка электронов в трансмиссионном электронном микроскопе
Для подготовки материала к исследованию используют различные приемы (они описаны ниже), но в любом случае материал должен быть мертвым, так как в процессе наблюдения он находится в вакууме, быстро нагревается и начинает разрушаться под действием пучка электронов. Фотографировать необходимо для регистрации информации в том случае, если требуется длительное изучение образца.
1. Окрашивание ультратонких срезов тяжелыми металлами. Срезы готовятся на ультратоме и окрашиваются соединениями тяжелых металлов, такими, как нитрат свинца, уранилацетат или осмиевая кислота. Окрашенные участки становятся малопроницаемыми для электронов, и, таким образом, на микрофотографиях они выглядят темными.
2. Негативное контрастирование. При негативном контрастировании окрашивается фон, тогда как сам образец остается неокрашенным. Этот метод особенно удобен при изучении деталей строения поверхности мелких частиц, таких, как рибосомы, вирусы и фрагменты изолированных органелл и мембран, так как краситель проникает между деталями поверхностного строения.
3. Напыление. Образец бомбардируется атомами тяжелых металлов, например золотом или платиной, в определенном направлении или под определенным углом. Поверхность образца покрывается слоем металла, непроницаемого для электронов. Закрытые площади, в том числе "тень" за образцом, не покрываются металлом и остаются относительно прозрачными для электронов. Они дают белый цвет (пропускают электроны, которые равнозначны свету). Так как человеческий глаз лучше воспринимает и интерпретирует темные отпечатки, обычно печатают негативы фотографий. Напыление используют также, чтобы выявить структуру поверхности мелких частиц, например вирусов.
4. Замораживание - скалывание и замораживание - травление. Фрагмент ткани быстро замораживается при очень низкой температуре и затем разламывается с помощью очень острого металлического лезвия. Ткань трескается вдоль слабо соединенных плоскостей, которыми часто являются мембраны (рис. П.2.7). Образец выдерживают на холоде в глубоком вакууме; в этих условиях лед возгоняется, оставляя сколотую поверхность.
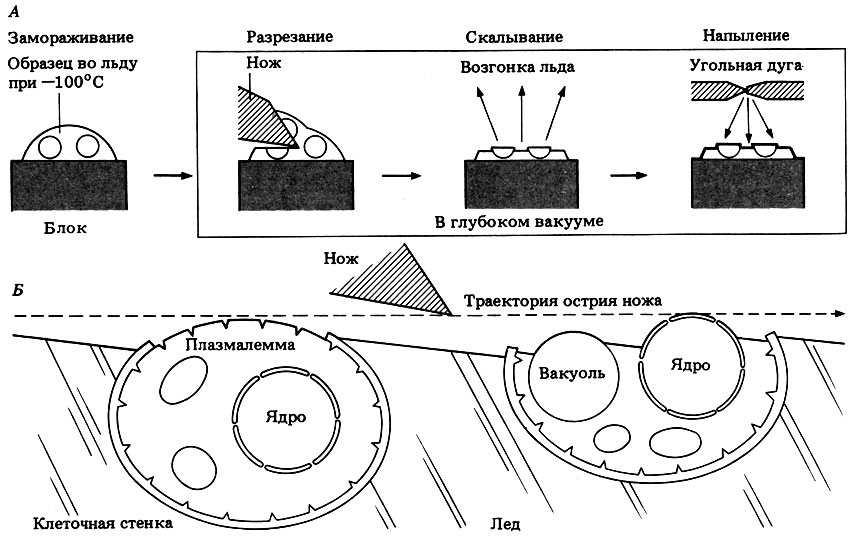
Рис. П.2.7. А. Схематическое изображение метода замораживания - скалывания. Б. Обнажение клеточных мембран в процессе скалывания
Реплика этой поверхности создается откладывающимся на ней слоем углерода. На эту реплику из углерода напыляется тяжелый металл, а ткани под репликой разрушаются, как правило, действием сильной кислоты при нормальном атмосферном давлении. Этот метод очень удобен при изучении структуры мембраны (см. рис. 7.15 и 9.13). Его преимущество состоит в том, что живые ткани быстро умерщвляются, не подвергаясь химической обработке, которая может повлиять на их структуру. Вполне вероятно, что такие клетки сохраняют свою прижизненную форму; тем самым подтверждаются данные, полученные с помощью общепринятых гистологических методик.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'