
Глава 9. Антибиотики. Химиопрофилактика и химиотерапия
Общая характеристика - Н. А. Бельская
Антибиотики (от греч. anti - против, bios - жизнь) - продукты жизнедеятельности живых организмов, способные избирательно убивать микроорганизмы или подавлять их рост.
Выработка антибиотиков микроорганизмами является одним из важнейших проявлений микробного антагонизма (от греч. antagonizomai - борюсь, соперничаю). Наибольшее число микроорганизмов, обладающих антагонистическими свойствами, встречается в почве, особенно среди грибов, актиномицетов, спороносных бактерий. Антагонисты выявляются и в водоемах (реки, озера), а также среди представителей нормальной микрофлоры человека и животных. Например, кишечная палочка, бифидум-бактерии, лактобациллы в кишечнике людей (см. главу 6). Первые попытки практического использования микробного антагонизма принадлежат Л. Пастеру и И. И. Мечникову.
Л. Пастер в 1877 г. установил, что гнилостные бактерии подавляют рост сибиреязвенных бацилл при совместном выращивании их на питательной среде. В результате своих наблюдений Пастер высказал предположение о возможности использовать явление антагонизма бактерий для лечения инфекционных заболеваний.
И. И. Мечников (1894), изучая роль гнилостных бактерий кишечника, установил, что они систематически отравляют организм продуктами своей жизнедеятельности и это способствует преждевременному старению людей. Он обнаружил также, что молочно-кислые бактерии (болгарская палочка), находящиеся в простокваше, подавляют развитие гнилостных бактерий кишечника и предложил использовать антагонистические отношения микроорганизмов как один из методов борьбы со старостью.
Русские ученые В. А. Манассейн и А. Г. Полотебнов (1871-1872) за много лет до открытия антибиотиков применяли зеленую плесень пенициллиум для лечения гнойных ран и других поражений кожи.
Идея использовать один вид микроорганизмов в борьбе против другого (антагонизм) принесла существенные плоды. Из синегнойной палочки был получен первый антибиотик - пиоционаза (Р. Эммерих, О. Лев), но он не нашел широкого применения.
Начало учения об антибиотиках положено в 1929 г., когда английский ученый А. Флеминг обнаружил на чашках с посевами золотистого стафилококка лизис колоний вблизи случайно выросшей плесени Penicillium notatum. Флеминг установил, что фильтрат бульонной культуры плесени убивает не только стафилококки, но и другие микроорганизмы. В течение 10 лет Флеминг пытался получить пенициллин в химически чистом виде. Однако это ему не удалось. Очищенный препарат пенициллина, пригодный для клинического использования, получили английские исследователи Э. Чейн и Г. Флори в 1940 г.
Советский микробиолог З. В. Ермольева применила для получения пенициллина другой вид плесени - Penicillium crustosum (1942) и явилась одним из организаторов производства пенициллина во время Великой Отечественной войны.
Открытие пенициллина и успешное применение его для лечения гнойно-воспалительных процессов и ряда других инфекционных болезней побудило ученых к поиску новых антибиотиков, оказывающих губительное действие на различные микроорганизмы. В настоящее время получено свыше 2000 различных антибиотиков. Однако в клинической практике используются далеко не все, так как одни оказались токсичными, другие - неактивными в условиях организма человека.
Источником получения антибиотиков служат разнообразные микроорганизмы, обладающие антимикробной активностью. Антибиотики выделяют из плесневых грибов (пенициллин и др.), актиномицетов (стрептомицин, тетрациклин и др.), бактерий (грамицидин, полимиксины); вещества, обладающие антибиотическим действием, получают также из высших растений (фитонциды лука, чеснока) и тканей животных (лизоцим, экмолин, интерферон).
Антибиотики могут оказывать на микроорганизмы бактериостатическое и бактерицидное действие. Бактерицидное действие антибиотиков вызывает гибель микроорганизмов, а бактериостатическое - подавляет или задерживает их размножение. Характер действия зависит как от антибиотика, так и от его концентрации.
Классификация антибиотиков может быть основана на различных принципах: по источнику получения, химическому строению, механизму и спектру антимикробного действия, способу получения. Чаще всего классифицируют антибиотики по спектру антимикробного действия и источникам получения.
Механизм антимикробного действия антибиотиков разнообразен: одни нарушают синтез клеточной стенки бактерий (пенициллин, цефалоспорины), другие тормозят процессы синтеза белка в клетке (стрептомицин, тетрациклин, левомицетин), третьи угнетают синтез нуклеиновых кислот в бактериальных клетках (рифампицин и др.).
Для каждого антибиотика характерен спектр действия, т. е. препарат может оказывать губительное действие на определенные виды микроорганизмов. Антибиотики широкого спектра активны в отношении различных групп микроорганизмов (тетрациклины) или угнетают размножение многих грамположительных и грамотрицательных бактерий (стрептомицин и др.). Ряд антибиотиков действует в отношении более узкого круга микроорганизмов, например к полимиксину чувствительны преимущественно грамотрицательные бактерии.
По спектру действия антибиотики разделяют на антибактериальные, противогрибковые и противоопухолевые.
Антибактериальные антибиотики угнетают развитие бактерий и составляют наиболее обширную группу препаратов, различных по химическому составу. Для лечения инфекционных болезней, вызываемых бактериями, чаще используют антибиотики широкого спектра действия: тетрациклины, левомицетин, стрептомицин, гентамицин, канамицин, полусинтетические пенициллины и цефалоспорины и другие препараты.
Противогрибковые антибиотики (нистатин, леворин, амфотерицин В, гризеофульвин) оказывают угнетающее действие на рост микроскопических грибов, так как нарушают целостность цитоплазматической мембраны микробных клеток. Применяются для лечения грибковых заболеваний.
Противоопухолевые антибиотики (рубомицин, брунеомицин, оливомицин) угнетают синтез нуклеиновых кислот в животных клетках и используются для лечения различных форм злокачественных новообразований.
Биологическую активность антибиотиков измеряют в международных единицах действия (ЕД). За единицу активности антибиотика принимают наименьшее количество препарата, которое оказывает антимикробное действие на чувствительные к нему тест-бактерии (например, для пенициллина - золотистый стафилококк, стрептомицина - кишечная палочка и т. п.). В настоящее время единицы активности антибиотиков выражают в микрограммах* чистого препарата. Так, за единицу активности пенициллина принимают 0,6 мкг, а для большей части антибиотиков 1 ЕД соответствует 1 мкг (стрептомицин и др.).
* (1 мкг - 10-6 г.)
В нашей стране создана мощная промышленность по производству антибиотиков. Природные антибиотики получают биосинтетическим путем: штаммы-продуценты грибов, актиномицетов, бактерий выращивают в жидкой питательной среде соответствующего состава, при определенном значении рН, оптимальной температуре и аэрации. Антибиотические вещества являются конечными продуктами метаболизма микроорганизмов и продуцируются клетками в питательную среду, откуда их извлекают химическими методами.
Изучение химической структуры антибиотиков позволило получать синтетические препараты методом химического синтеза (левомицетин).
Большим достижением является разработка методов получения полусинтетических антибиотиков, основанных на изменении химической структуры природного препарата. В результате этого удалось расширить спектр антимикробного действия, устранить некоторые недостатки природных антибиотиков. В последние годы в клинической практике широко применяют полусинтетические пенициллины, цефалоспорины, тетрациклины, рифампицин и другие препараты.
Антибиотикотерапия иногда может сопровождаться осложнениями со стороны макроорганизма, а также вызывать изменения различных свойств микроорганизмов.
Возможные осложнения при антибиотикотерапии. Некоторые антибиотики (пенициллин, стрептомицин и др.), введенные в организм больного, вызывают состояние повышенной чувствительности (аллергия), нарастающее по мере применения препарата. Аллергические реакции развиваются в виде сыпи-крапивницы, отеков век, губ, носа, дерматитов. Наиболее грозным осложнением является анафилактический шок (см. главу 13), от которого может наступить смерть больного*.
* (Чем лучше очищен антибиотик от балластных веществ, тем он реже и в меньшей степени вызывает выраженные аллергические акции.)
Внимание! Прежде чем применять антибиотик парентерально, необходимо выявить отсутствие повышенной чувствительности к нему организма больного. Это определяют с помощью внутрикожной пробы с данным препаратом: в кожу внутренней стороны предплечья вводят 0,1 мл антибиотика и наблюдают в течение 20-30 мин. Если реакция положительная (диаметр папулы более 1 см и большая зона красноты), то антибиотик вводить нельзя.
Введение в организм больших доз антибиотиков широкого спектра действия, как правило, сопровождается и гибелью представителей нормальной микрофлоры дыхательных путей, кишечника и других органов. Это приводит к изменению обычных антагонистических отношений между микроорганизмами в естественных условиях. В результате этого условно-патогенные бактерии (стафилококки, протей) и грибы рода Candida, устойчивые к этим антибиотиком, могут активизироваться и вызывать вторичные инфекции. Так возникают грибковые поражения - кандидозы кожи, слизистых оболочек, внутренних органов; дисбактериозы (нарушения нормального состава микрофлоры).
Для предотвращения развития кандидамикозов антибиотики вводят с противогрибковыми препаратами, например нистатином и др. Применение препаратов, приготовленных из представителей нормальной микрофлоры (колибактерин, бифидумбактерин, бификол) после приема антибиотиков, предупреждает развитие дисбактериоза.
Длительное лечение и применение антибиотиков может оказывать токсическое действие на организм больного: тетрациклины могут вызвать поражение печени, левомицетин - органов кроветворения, стрептомицин в ряде случаев поражает вестибулярный и слуховой анализаторы, цефалоспорины способны нарушать функции почек (нефротоксичность). Многие антибиотики часто вызывают гиповитаминоз и раздражение слизистой оболочки желудочно-кишечного тракта.
Антибиотики могут оказывать вредное действие на развитие плода, особенно у женщин, употреблявших антибиотики в первый период беременности. Прямое влияние на организм плода оказывают антибиотики группы тетрациклина.
Устойчивость микроорганизмов к антибиотикам. Часто при лечении антибиотиками происходит превращение чувствительных к антибиотику микроорганизмов в устойчивые (резистентные) формы. Приобретенная устойчивость бактерий к антибиотику передается по наследству новым популяциям бактериальных клеток.
Механизм образования устойчивости разнообразен (см. главу 10). В большинстве случаев резистентность связана со способностью бактерий синтезировать ферменты, разрушающие определенные антибиотические вещества. Например, устойчивость стафилококков к пенициллину объясняется их способностью вырабатывать фермент пенициллиназу, разрушающий антибиотик. В то же время для кишечной палочки, протея и других бактерий семейства кишечных пенициллиназа является конститутивным (постоянным) ферментом и определяет их естественную резистентность к пенициллину.
У некоторых бактерий обнаружена множественная лекарственная устойчивость, т. е. бактериальная клетка может обладать резистентностью к нескольким антибиотикам. Особенно выражена резистентность к пенициллину и стрептомицину, которые первыми стали использовать в клинической практике.
Эффективность антибиотикотерапии определяется главным образом степенью чувствительности бактерий к применяемому препарату. Поэтому проверяют чувствительность культур микроорганизмов, выделенных от больных, к различным антибиотикам, которые используют для лечения.
В процессе действия антибиотиков возможно изменение морфологических, культуральных, биологических свойств бактерий; могут образовываться L-формы (см. главу 3).
Антибиотики, выделенные из грибов. Из некоторых штаммов грибов рода Penicillium (Penicillium notatum, Penicillium chrysogenum) получен пенициллин.
Пенициллин - высокоактивен в отношении патогенных кокков: грамположительных стафилококков, стрептококков, пневмококков; грамотрицательных - менинго- и гонококков. Его используют для лечения сибирской язвы, столбняка, газовой гангрены, сифилиса и других заболеваний. Вводится пенициллин парентерально. Препарат нельзя применять перорально, так как он теряет свою активность в кислой и щелочной средах и разрушается в желудочно-кишечном тракте.
Уже в самом начале применения пенициллина было замечено, что он быстро выводится из организма, и для поддержания необходимой для терапевтического эффекта концентрации пенициллина в крови его вводят каждые 3-4 ч.
В дальнейшем были созданы препараты пенициллина, обладающие пролонгированным (продленным) действием. К ним относят экмоновоциллин, бициллин-1, бициллин-3, бициллин-5. Бициллин-1, 3, 5 - антибиотики, которые с успехом используются для лечения ревматизма и сифилиса.
В настоящее время получены полусинтетические пенициллины: метициллин, оксациллин, клоксациллин, которые не разрушаются пенициллиназой и применяются для лечения инфекций, вызванных устойчивыми к пенициллину стафилококками; ампициллин активен не только в отношении грамположительных, но и грамотрицательных бактерий (возбудителей брюшного тифа, дизентерии и др.). Оксациллин и ампициллин устойчивы к кислой среде желудка, что позволяет применять их перорально.
Грибами рода Cephalosporium продуцируется антибиотик цефалоспорин. Его полусинтетические производные, из которых наибольшее применение нашли цепорин (цефалоридин) и цефомезин, малотоксичны, обладают широким спектром действия, не разрушаются пенициллиназой, не дают аллергических реакций у лиц, чувствительных к пенициллину, и широко используются для лечения многих инфекционных болезней.
Антибиотики, образуемые актиномицетами. Впервые антагонистическое действие лучистых грибов (актиномицетов) установил Н. А. Красильников (1939). Из Actinomyces globisporus американским ученым А. Ваксманом (1943) был выделен стрептомицин. Открытие стрептомицина ознаменовало новую эпоху в борьбе с туберкулезом, так как к препарату оказались чувствительны микобактерии туберкулеза. Стрептомицин оказывает губительное действие на многие грамположительные и грамотрицательные бактерии и применяется для лечения чумы, туляремии, бруцеллеза и др. Вводится антибиотик парентерально.
Бактерии быстро приобретают устойчивость к стрептомицину. Некоторые микроорганизмы образуют стрептомицинозависимые формы, которые могут размножаться на питательных средах лишь при добавлении антибиотика.
Актиномицеты являются продуцентами природных антибиотиков группы тетрациклина (тетрациклин, хлортетрациклин, окситетрациклин). Все препараты обладают широким спектром действия, подавляют размножение многих видов грамположительных и грамотрицательных бактерий, риккетсий, некоторых простейших (дизентерийная амеба). Тетрациклин быстро всасывается из желудочно-кишечного тракта, его назначают с нистатином для профилактики кандидозов.
За последние годы широкое применение нашли полусинтетические производные окситетрациклина (метациклин, доксициклин и др.), которые оказались более эффективными по сравнению с природными препаратами.
Левомицетин - синтетический препарат, идентичный природному хлорамфениколу, выделенному из культуральной жидкости Streptomyces venezuelae. Антимикробный спектр левомицетина включает многие грамположительные и грамотрицательные бактерии, риккетсий, спирохеты. Наиболее часто левомицетин используется для лечения кишечных инфекций - брюшного тифа, паратифов, дизентерии, а также различных риккетсиозов - сыпного тифа и других заболеваний.
Из актиномицетов получены антибиотики: эритромицин, олеандомицин, канамицин, рифампицин, линкомицин и др. Эти препараты относят к антибиотикам "резерва" и применяют их для лечения заболеваний, вызванных бактериями, резистентными к другим антибиотикам.
Антибиотики, продуцируемые бактериями. Наибольшее практическое значение имеют полимиксины и грамицидин С.
Полимиксины объединяют группу родственных антибиотиков, продуцируемых спорообразующими почвенными бациллами - В. polimixa. Полимиксины В, М и Е активны в основном в отношении грамотрицательных бактерий (энтеробактерии, синегнойная палочка и др.).
Грамицидин С выделен советскими учеными Г. М. Гаузе и М. Г. Бражниковой (1942) из различных штаммов почвенных бацилл - B. brevis. К нему чувствительны грамполбжительные бактерии. Грамицидин С может вызывать гемолиз эритроцитов, поэтому применяется только местно для лечения нагноительных процессов.
Антибиотические вещества, полученные из высших растений. Советский исследователь Т. П. Токин (1928) обнаружил, что многие высшие растения образуют летучие вещества, обладающие антимикробным действием (фитонциды). Они защищают растения от болезнетворных микроорганизмов. Фитонциды - летучие эфирные масла, которые чрезвычайно нестойки, вследствие чего получать препараты фитонцидов в чистом виде очень сложно.
Фитонциды выделены из сока лука, чеснока, листьев эвкалипта и лишайника, травы зверобоя. Обнаружены они также в соке хрена, редиса, алоэ и других растений. Применение фитонцидов в медицинской практике ограничено, так как не удается получить хорошо очищенные, стойкие и малотоксичные препараты.
Антимикробные вещества, выделенные из тканей животных. Лизоцим был впервые обнаружен русским ученым Н. П. Лащенковым (1909) в белке куриного яйца. Позднее лизоцим выявили в молоке, слезной жидкости, слюне и тканях различных органов (почках, селезенке, печени); установили, что он как естественный защитный фактор организма оказывает бактериолитическое (растворяющее бактерий) действие на многие патогенные и сапрофитные микроорганизмы. Его используют для лечения глазных и кожных болезней.
Экмолин был выделен З. В. Ермольевой из тканей рыб. Применяется он в сочетании с пенициллином (экмоновоциллин), так как усиливает и продлевает его действие в организме.
Особый интерес представляет интерферон, образующийся в клетках организма под действием вирусов и являющийся фактором естественной защиты клетки от размножения вирусов. Интерферон, открытый Айзексом и Линдеманом (1957), обладает широким антивирусным спектром. Изучение механизма действия интерферона показало, что он препятствует синтезу нуклеиновых кислот многих вирусов и вызывает их гибель. Интерферону присуща видовая специфичность: человеческий интерферон не влияет на вирусы в организме животных.
Выделяют интерферон из лейкоцитов человека и обозначают его Иф-α. Применяют для профилактики и лечения гриппа и других вирусных респираторных заболеваний. В последние годы появились сообщения об эффективном действии интерферона при некоторых злокачественных новообразованиях.
Контрольные вопросы
1. Что представляют собой антибиотики?
2. Какое явление лежит в основе действия антибиотиков?
3. Каковы источники получения антибиотиков?
4. Как различаются антибиотики по механизму антимикробного действия?
5. Каков характер действия антибиотиков?
6. Что называют антимикробным спектром антибиотиков?
7. Какие возможны осложнения со стороны макроорганизма при антибиотикотерапии?
8. Какие свойства могут изменяться у микроорганизмов под влиянием антибиотиков?
Чувствительность микроорганизмов к антибиотикам - Н. А. Бельская
(Согласно Приказу Министерства здравоохранения СССР № 250 от 13.03.75 г. "Об унификации методов определения чувствительности микроорганизмов к химиотерапевтическим препаратам".)
В клинической практике чувствительными к антибиотикам считают те микроорганизмы, на которые антибиотики оказывают бактериостатическое или бактерицидное действие.
При любом лабораторном исследовании критерием чувствительности микроорганизмов к антибиотикам является минимальная концентрация антибиотика, ингибирующая (задерживающая) рост возбудителя заболевания при стандартных условиях постановки опыта.
Для определения лекарственной чувствительности оптимальным является использование чистой культуры возбудителя. Выделять культуры микробов из организма для исследования на чувствительность следует до начала лечения антибиотиками, так как под их воздействием рост возбудителя заболевания может быть полностью угнетен. Чувствительность микроорганизмов к антибиотикам определяют методом диффузии в агар с применением стандартных дисков или методом серийных разведений в жидких и плотных питательных средах.
Методы определения
Метод дисков. Взвесь изучаемой культуры засевают "газоном" (см. главу 7). В качестве посевного материала можно использовать суточную бульонную культуру или 1 миллиардную микробную взвесь, приготовленную по оптическому стандарту мутности № 10 (см. ниже). Засеянные чашки подсушивают 30-40 мин при комнатной температуре. Затем на поверхность засеянного агара пинцетом накладывают бумажные диски, пропитанные растворами различных антибиотиков. Каждый диск слегка прижимают браншами пинцета, чтобы он плотно прилегал к поверхности агара. Диски накладывают на равном расстоянии друг от друга и на расстоянии 2 см от края чашки. Одну чашку можно использовать для изучения чувствительности одного штамма к 4-5 антибиотикам.
Засеянные чашки с нанесенными на них дисками помещают в термостат при 37° С на 18-24 ч. Чашки ставят вверх дном, чтобы избежать попадания конденсационной воды на поверхность посевов.
Учет результатов. Действие антибиотиков оценивают по феномену задержки роста вокруг диска (рис. 25). Диаметр зон задержки роста микробов вокруг дисков определяют с помощью линейки, включая диаметр самого диска. Между степенью чувствительности микроба к антибиотикам и величиной зоны отсутствия роста имеются следующие соотношения (табл. 10).
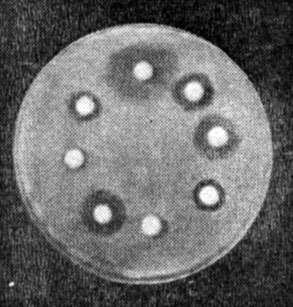
Рис. 25. Определение чувствительности бактерий к антибиотикам (метод дисков)
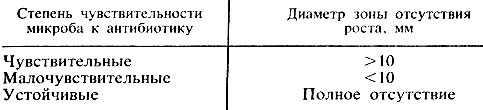
Таблица 10. Определение степени чувствительности микроорганизмов к антибиотикам по величине зоны отсутствия роста
В ответе указывают, какой чувствительностью обладает исследуемый штамм, а не размер зоны задержки роста.
В ряде случаев определяют чувствительность микроорганизмов к антибиотикам в нативном материале (гной, раневое отделяемое и др.). При этом материал наносят на поверхность питательного агара и равномерно растирают по поверхности стерильным стеклянным шпателем*, а потом накладывают диски. Метод дисков для определения чувствительности микроорганизмов вследствие простоты и доступности широко применяют в практических лабораториях и расценивают как качественный метод.
* (Для тех видов микроорганизмов, которые не растут на мясопептонном агаре, как, например, стрептококки, пневмококки и другие, применяют агар с кровью или сывороткой.)
Метод серийных разведений в жидкой питательной среде. Этот метод является точным количественным методом, его применяют в научной работе и в особо важных случаях в лабораториях больниц и профилактических учреждений.
Для постановки опыта необходимо иметь чистую культуру испытуемого микроорганизма, основной раствор антибиотика, мясопептонный бульон на переваре Хоттингера, содержащий 1,2-1,4 г/л аминного азота.
Активность антибиотиков выражают в ЕД/мл или мкг/мл. Для приготовления основного раствора антибиотика используют антибиотики, имеющиеся в продаже с указанием количества их во флаконе.
Если на этикетке вместо количества единиц во флаконе дозировка указана в единицах массы, то следует иметь в виду, что 1 г активности для большей части антибиотиков соответствует 1 млн. ЕД. Из этого раствора и должны быть приготовлены требуемые разведения антибиотиков. Указания для приготовления основного раствора антибиотиков на примере пенициллина приведены в табл. 11.

Таблица 11. Получение основного раствора пенициллина
Готовят взвесь культуры микроорганизмов, выросшей на плотной питательной среде. Полученную взвесь сравнивают с оптическим стандартом мутности № 10 (см. ниже), а затем разводят стерильным изотоническим раствором натрия хлорида до 106 микробных тел в 1 мл. Для получения соответствующего разведения микробной взвеси готовят ряд последовательных десятикратных разведений (см. ниже).
Постановка опыта. В 12 стерильных пробирок разливают по 1 мл жидкой питательной среды. В 1-ю пробирку вносят 1 мл основного раствора антибиотика, содержащего, например, 32 ЕД в 1 мл. Содержимое 1-й пробирки перемешивают и 1 мл переносят во 2-ю пробирку, из 2-й - в 3-ю, из 3-й - в 4-ю и так до 10-й, из которой 1 мл удаляют. Таким образом, 1-я пробирка будет содержать 16 ЕД, 2-я - 8 ЕД, 3-я - 4 ЕД и т. д. Для приготовления каждого разведения используют отдельную пипетку. Содержимое 11-й пробирки служит контролем роста бактерий, а 12-й - контролем стерильности питательной среды. Во все пробирки, кроме 12-й, вносят 0,1 мл испытуемой культуры определенной густоты. Посев инкубируют в термостате в течение 18-24 ч и регистрируют результаты опыта.
Учет результатов проводят при наличии роста в контроле культуры и отсутствии роста в контроле среды. Затем отмечают последнюю пробирку с полной видимой задержкой роста микробов. Количество антибиотика в этой пробирке является минимальной ингибирующей концентрацией для испытуемого штамма и определяет степень его чувствительности к данному антибиотику. В ответе, выдаваемом лабораторией, указывают минимальную ингибирующую концентрацию.
Метод серийных разведений на плотной питательной среде. Готовят двукратные разведения антибиотика, как и при методе серийных разведений в жидкой питательной среде. Затем берут 1 часть каждого разведения антибиотика и 9 частей питательного агара, расплавленного и охлажденного до 42° С (из расчета 1 мл антибиотика + 9 мл МПА), хорошо перемешивают и наливают в чашки Петри.
Густоту (концентрацию) культуры определяют по оптическому стандарту мутности № 10 и разводят стерильным изотоническим раствором до 107 микробных тел в 1 мл. Бактериальной петлей наносят испытуемые культуры на поверхность питательного агара с антибиотиком. На одну чашку делают посев 20-25 штаммов. Засеянные чашки ставят в термостат при 37° С на 16-20 ч для большинства видов микроорганизмов. Чашка с питательным агаром без антибиотика, на которую наносят испытуемые культуры, является контрольной.
Учет результатов проводят при наличии роста в контрольной чашке, а минимальную ингибирующую концентрацию антибиотика определяют по последней чашке Петри, где отмечают полную задержку роста бактерий.
Метод дорожки по Флемингу. Метод применяют для определения спектра действия антибиотика. В чашке Петри с МПА стерильным скальпелем вырезают дорожку шириной 1 см и удаляют ее. Затем в пробирку с растопленным и охлажденным до 42-45° С мясопептонным агаром вносят определенную концентрацию раствора антибиотика. Содержимое пробирки перемешивают и выливают в дорожку так, чтобы жидкость не выходила за ее пределы. После застывания агара перпендикулярно к дорожке засевают петлей культуры нескольких исследуемых микроорганизмов. Посевы помещают в термостат на 18-24 ч.
Учет результатов. Чувствительные к препарату культуры начинают расти лишь на некотором расстоянии от дорожки, нечувствительные растут до самого края.
Методика работы с оптическим стандартом мутности
Для определения количества микробных тел в 1 мл используют оптические стандарты мутности. Их изготовляет Государственный НИИ стандартизации и контроля медицинских биологических препаратов МЗ СССР им. Л. А. Тарасевича (ГИСК). Существуют следующие стандарты мутности:
0,5 млрд. микробов в 1 мл - № 5 (5 ед. мутности) 0,9 " " " 1 " - № 9 (9 " " ) 1 " " " 1 " - № 10 (10 " " ) 1,1 " " " 1 " - № 11 (11 " " )
Перед определением количества микробных тел в 1 мл сначала получают микробную взвесь. Для этого в пробирку с выросшей на скошенном агаре культурой наливают 5-6 мл изотонического раствора натрия хлорида и, вращая пробирку между ладонями, смывают культуру с поверхности среды. Часть полученной взвеси переносят стерильной пипеткой в стерильную пробирку, толщина стенки и диаметр которой соответствует пробирке оптического стандарта. Затем сравнивают густоту полученной микробной взвеси с одним из оптических стандартов мутности. В случае необходимости микробную взвесь разводят, прибавляя изотонический раствор натрия хлорида до нужной мутности. Если мутность полученной микробной взвеси совпадает с мутностью оптического стандарта, то количество микробных тел в ней соответствует номеру стандарта.
Контрольные вопросы
1. Что является критерием чувствительности микроорганизмов к антибиотикам при лабораторном исследовании?
2. Когда следует выделять культуры микроорганизмов из организма больных для определения чувствительности к антибиотикам?
3. Какие существуют методы определения чувствительности микроорганизмов к антибиотикам?
Задание
1. Возьмите у преподавателя флакон с пенициллином, содержащий в 1 мл 300000 ЕД, и приготовьте основной раствор антибиотика в 32 ЕД/мл.
2. Определите чувствительность микроорганизмов к антибиотикам методом бумажных дисков, учтите результаты и дайте ответ.
3. Определите чувствительность выделенной культуры стафилококков к пенициллину методом серийных разведений в жидкой питательной среде, учтите результаты и дайте ответ.
Химиопрофилактика и химиотерапия
В медицинской практике для предупреждения и лечения инфекционных болезней давно применяли химические вещества. Индейцы для борьбы с малярией употребляли кору хинного дерева, а в Европе уже в XVI веке применяли ртуть для лечения сифилиса. Химиотерапия - это применение для лечения заболевания химических веществ, обладающих специфическим действием на клетки возбудителя заболевания и не повреждающих клетки и ткани человека. Основы научной химиотерапии были сформулированы П. Эрлихом. Он получил первые химиотерапевтические препараты - сальварсан и неосальварсан, содержащие мышьяк. В течение нескольких десятилетий их использовали при лечении сифилиса.
Химиопрофилактика - применение химических препаратов для предупреждения инфекционных заболеваний.
В основе действия химиотерапевтических препаратов на клетки возбудителей заболеваний лежит сходство их молекул с рядом веществ, необходимых для метаболизма микроорганизмов: аминокислот, витаминов, ферментов и т. д. Препарат всасывается бактериальной клеткой вместо необходимого ей компонента и начинает свое разрушительное действие. В результате нарушения важнейших систем клетки она погибает (бактерицидное действие), а если нарушения слабые, то отмечается бактериостатическое действие.
Важным этапом в развитии химиотерапии явилось создание сульфаниламидных препаратов (стрептоцид, норсульфазол, сульфадимезин и др.). Они дают хороший лечебный эффект при ангине, гнойно-воспалительных инфекциях, кишечных заболеваниях. В борьбе с туберкулезом помогли синтетические химиотерапевтические препараты ПАСК (парааминосалициловая кислота), тибон, фтивазид и др. В настоящее время разрабатывают и применяют химические противовирусные и противоопухолевые препараты. Большое значение имеют антибиотики - химиотерапевтические препараты биологического происхождения.
Однако химиотерапевтические препараты обладают рядом отрицательных свойств. Воздействуя на определенную цепь обмена веществ, они могут наряду с клеткой возбудителя поражать и клетки человека. В результате лечения химиопрепаратами в организме человека накапливается большое количество промежуточных продуктов, обладающих побочным действием. Описаны случаи изменения состава крови, мутации клеток и другие функциональные нарушения организма человека в результате применения химиотерапевтических препаратов.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'