
6. Эксперименты Фокса по использованию высоких температур для синтеза в безводных средах
Совершенно другим путем в попытках синтезировать неорганическим путем громадные молекулы белков пошли Фокс и сотр. [8, 9, 15]. Как мы знаем, молекулы белков построены из одной или нескольких полипептидных цепей, а те в свою очередь состоят из большого и даже очень большого числа разных аминокислот.
После того как образовались аминокислоты, может произойти следующий шаг - их объединение в полипептидные цепи (фиг. 16 и 35). Эту реакцию можно описать следующим уравнением (R и R' - различные радикалы):
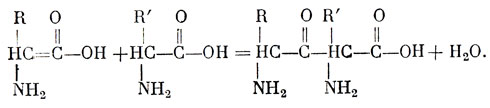
Фокс считает, что выделение молекулы воды, сопровождающее реакцию соединения двух молекул аминокислот, - факт большой важности. Поскольку реакция полимеризации, вернее поликонденсации, сопровождается дегидратацией, очевидно, степень и скорость превращения будут выше при удалении воды из системы. Это соображение привело Фокса к выводу, что раннее развитие жизни должно было происходить вблизи действующих вулканов, - а всем известно, что в ранние периоды геологической истории вулканическая деятельность шла более активно, чем в последующие времена.
Фокс провел эксперименты, в которых безводную смесь аминокислот подвергали воздействию температур до 170°С. Оказалось, что великолепные результаты получаются со смесями, содержащими аспарагиновую и глутаминовую кислоты. Почему это так, до сих пор непонятно*. Кстати, интересно, что именно эти две аминокислоты можно причислить к числу важнейших аминокислот, встречающихся в современных организмах.
* (В присутствии избытка аспарагиновой и глутаминовой кислоты смесь аминокислот переходит в необходимое для осуществления реакции жидкое состояние (расплав) при гораздо более низкой температуре. В противном случае она просто обугливается. - Прим. ред.)
В опытах Фокса образовывались соединения, во всех существенных отношениях сходные с природными белками. Так, они состоят из крупных молекул с молекулярной массой до 300000, сложенных из тех же блоков, что и природный белок. Они содержат 18 из 23 аминокислот, обычно встречающихся у современных организмов. Таким образом, они отвечают общему определению белка. С природным белком они сходны и по ряду других важных свойств, например по связыванию полинуклеотидов [41], по пригодности в пищу бактериям и крысам, по способности вызывать реакции, сходные с теми, которые катализируются ферментами в организмах. Так, эти искусственно синтезированные "органические" соединения способны каталитически разлагать глюкозу. Активность их, правда, мала, но, как указывается в сообщении об этом [14], "...первым белкам достаточно было проявлять хотя бы слабую активность". Кроме того, эти вещества могут оказывать действие, аналогичное действию меланоцитстимулирующего гормона [16].
С тех пор многое было сделано для изучения активности этих соединений, и Фокс [11-13] смог сообщить о многих других ее проявлениях (фиг. 34). Терминология с тех пор также усовершенствовалась, и вместо "ферментативной активности" в применении к этим веществам теперь употребляют термин "каталитическая" или даже "ускоряющая" активность. Это делают для того, чтобы провести различие между активностью искусственно синтезированных белковоподобных соединений (так называемых протеиноидов) и активностью соединений, свойственных современным организмам. Конечно, функция ферментов, по сути дела, и есть катализ, т. е. ускорение реакций, но все же довольно слабая активность протеиноидов может показаться несравнимой с сильным и высокоспецифичным действием современных ферментов. Можно назвать активность протеиноидов, скажем, "предферментной". Главное - не в ее отличиях от действия современных ферментов, а в том, что она уже существовала в период перехода от преджизни к ранней жизни, когда высокоактивных и специфичных ферментов еще не было.
![Фиг. 34. Каталитическое, или 'ускоряющее', действие неорганически синтезированных протеиноидов [11]](pic/000048.jpg)
Фиг. 34. Каталитическое, или 'ускоряющее', действие неорганически синтезированных протеиноидов [11]
Другое важное свойство протеиноидных соединений, о котором мы еще поговорим в разд. 6 следующей главы, - их "ограниченная гетерогенность". Это значит, что последовательность аминокислот в их пептидных цепях не совершенно случайна, а, напротив, более или менее закономерна.
Фокс пишет, что пока невозможно провести строгое сравнение этих искусственных соединений с природными белками, так как молекулы белков настолько сложны, что структура большинства из них еще не определена с достаточной точностью. Стремясь подчеркнуть сходство этих искусственных белковоподобных соединений с природными белками, Фокс называет первые протеиноидами. Поскольку они были синтезированы под действием тепла, в дальнейшем их стали называть "термическими протеиноидами".
Полное, хотя и лаконичное описание экспериментов по синтезу этих термических протеиноидов можно найти в статье Фокса [8]*.
* (Приводим основные стадии их синтеза, согласно "термической теории происхождения жизни" по Фоксу [9]. Первым шагом было образование при очень высоких температурах аминокислот. Такой синтез вполне возможен наряду с другими, т. е. при воздействии электрических разрядов (Миллер), ультрафиолетового излучения (Поннамперума) и высокой температуры (Оро). Возможность такого термического синтеза экспериментально доказана Харадой и Фоксом [21].
Следующий шаг - поликонденсация полученных в опыте 18 аминокислот при температуре 170 или 65°С (в последнем случае в присутствии некоторых фосфатов). Эта поликонденсация происходит, если в смеси имеется Достаточно аспарагиновой и глутаминовой кислот.
В смеси протеиноидов при воздействии на нее водой или кислыми водными растворами (дождем) образуются микросферы (фото 4-7).
Способность протеиноидов к выполнению некоторых функций, сходных с функциями молекул живых организмов, выражается в том, что они могут в присутствии гидрата окиси цинка расщеплять нуклеотид АТФ, т. е. обладают слабой ферментативной активностью.)
![Фото 4. Протеиноидные микросферы, полученные промывкой горячих протеиноидных смесей (средний диаметр 2 мкм) (гл. VI, [9])](pic/000148.jpg)
Фото 4. Протеиноидные микросферы, полученные промывкой горячих протеиноидных смесей (средний диаметр 2 мкм) (гл. VI, [9])
![Фото 5. Протеиноидные микросферы, при слабом надавливании на препарат объединившиеся в цепочки, напоминающие водоросли (гл. VI, [9])](pic/000149.jpg)
Фото 5. Протеиноидные микросферы, при слабом надавливании на препарат объединившиеся в цепочки, напоминающие водоросли (гл. VI, [9])
![Фото 6. Протеиноидные микросферы, сдвоившиеся при повышении рН среды до 6,0 (гл. VI, [9])](pic/000150.jpg)
Фото 6. Протеиноидные микросферы, сдвоившиеся при повышении рН среды до 6,0 (гл. VI, [9])
![Фото 7. Электронные микрофотографии срезов микросфер. Ясно видны двойные стенки (X -1400 раз) (гл. VI, [9])](pic/000151.jpg)
Фото 7. Электронные микрофотографии срезов микросфер. Ясно видны двойные стенки (× ∼1400 раз) (гл. VI, [9])
Следует подробнее рассказать об одном весьма эффектном результате этих экспериментов, а именно об образовании микросфер из термических протеиноидов. Процесс несложен. Промывая горячую смесь искусственных полимеров водой или водными растворами солей, получают многочисленные микросферы. Они очень малы, их диаметр - около 2 мкм. Их морфологические особенности показаны на фото 4-7.
Микросферы довольно стабильны. Если их помещают в растворы иной концентрации, чем концентрация раствора, в котором они образовались, то можно наблюдать их реакцию. В слишком концентрированных растворах они сморщиваются, в разбавленных набухают, т. е. их реакция на изменение осмотического давления сходна с реакцией живых клеток. Видимо, это объясняется наличием у них полупроницаемой наружной оболочки, сходной с мембраной. Судя по электронным микрофотографиям, эта оболочка может быть даже двойной (фото 7).
Образование микросфер из термических протеиноидов важно потому, что оно дает нам материал для суждения о том, как мог произойти следующий шаг в развитии жизни. Это шаг от разрозненных "органических" молекул к группам таких молекул, собранным в отдельные структуры и отделенным от окружающего мира своеобразной мембраной. Мы еще вернемся к этому вопросу в следующей главе, в разделе о коацервации и образовании мембран.
Но мне как геологу трудно принять один аспект "термической теории", а именно роль высоких температур. Фокс подчеркивает, что такие температуры создавались во время извержения вулканов и в кратере, и на поверхности потоков горячей лавы. Как же тогда совместить идею о появлении малых молекул в "первичном бульоне" с дальнейшим развитием жизни в вулканах и около них при извержениях? Далее мы увидим (особенно в гл. XVI), что преджизнь и ранняя жизнь должны были очень долго сосуществовать, и мне кажется, что такие редкие и случайные события, как извержения вулканов, не могли способствовать появлению жизни из "органических" соединений.
Правда, в природе всегда образуются более разнообразные соединения, чем в упрощенных модельных экспериментах. Так, не исключено, что в природе сходные реакции могли бы идти и при более низких температурах с помощью какого-либо катализатора. Такая возможность уже показана и в опытах Фокса: при добавлении фосфатов к смеси аминокислот их конденсация происходила уже при 65°С (фиг. 34).
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'