
7. Состав морских вод
Мы так много говорим о "первичном бульоне", который в умах очень многих авторов тесно связан с океаном, что было бы уместно рассмотреть здесь свойства морской воды. В наши дни общий объем океанов составляет 1,37⋅109 км3, или 1,37⋅1021 л. Каков был их объем раньше, неизвестно. Если не принимать во внимание местные отклонения, обусловленные испарением или поступлением пресной речной воды, состав морской воды во всем мире поразительно постоянен. Основные ее компоненты перечислены в табл. 21. Соленость моря равна 3,5%, рН 8,2±0,2, а окислительно-восстановительный потенциал 12,5±0,2.
![Таблица 21. Концентрации основных компонентов нормальной морской воды [19]](pic/000111.jpg)
Таблица 21. Концентрации основных компонентов нормальной морской воды [19]
Раннее соленость морской воды объясняли таким образом: вначале океаны состояли из пресных водных масс, постепенно осолонившихся из-за поступления с речным стоком растворенных веществ. Заметим, кстати, что на этой концепции была основана одна из самых первых попыток оценки возраста Земли. Зная современный вынос растворенных веществ с суши и современный объем и соленость океана, можно рассчитать, когда началось накопление солей в морской воде*. Но этот метод столь же несостоятелен, сколь прост на первый взгляд: ведь мы не знаем, сколько растворенных веществ несли древние реки, каков был объем древних океанов, сколько солей попало в известняки и эвапориты и сколько вернулось в круговорот при позднейшей повторной эрозии.
* (Впервые этот принцип применил ученик Ньютона Эдмунд Галлей (1656-1742). Он оценил возраст Земли примерно в 10000 лет. - Прим. перев.)
Лишь в 50-х годах XX в. теория постоянно осолоняющегося океана была серьезно пересмотрена. По различным соображениям было принято, что время существования отдельных ионов в океане мало по сравнению с геологической историей. Другими словами, соленость морской воды - результат не накопления, а постоянной смены ионов. Кроме того, установилось мнение, что поразительное постоянство рН морской воды на всем земном шаре объясняется буферным действием карбонатной системы, т. е. взаимодействием между СаСО3, Са2+, СО32- НСО3- и Н2СО3.
В 1961 г. шведский химик Силлен выступил с возражениями против этой теории [45]. Он разработал непротиворечивую модель морской воды, используя константы химической активности основных компонентов морской воды и правило фаз Гиббса. Модель Силлена, прекрасно согласующаяся с современным составом морской воды, активно защищалась им в серии статей, нередко с весьма эмоциональными названиями, например "Как морская вода приобрела свой нынешний состав". Эта теория не претерпела значительных изменений, так что, кроме самой первой статьи (1961 г.), с ней можно ознакомиться и по статьям 1967 года [50, 51].
Кратко эта теория сводится к следующему. В ней учитываются лишь 8 компонентов морской воды: Н2O, НСl, SiO2, Al(OH)3, NaOH, KOH, MgO и СаО. В равновесии должны находиться 7 фаз: 1) водный раствор с составом, близким к составу морской воды, 2) кварц, 3-6) глинистые минералы каолинит, гидрослюда (или иллит), хлорит и монтмориллонит и 7) филлипсит или другой цеолит. Состав водного раствора и всех твердых веществ при данном давлении, температуре и концентрации ионов Сl- остается постоянным. Добавление СO2 приведет к осаждению известняка СаСO3; добавление FeO и Fe2O3 - к осаждению глауконита и гетита, но состав раствора, т. е. состав морской воды, почти не изменится.
По Силлену, состав морской воды забуферен не карбонатной системой, а тем, что он, как химик, называет "тонкозернистыми алюмосиликатами". Геолог назовет эти вещества глинистыми минералами. Геохимики и минералоги, занимающиеся глинами, подтвердили мнение Силлена [19, 26, 27, 29]. Мы покажем, как действует этот буферный механизм, на простом примере. На самом деле глинистые минералы устроены гораздо сложнее, чем изображено на упрощенной схеме строения монтмориллонита (фиг. 82). В кристаллической решетке глинистых минералов могут чередоваться не два, а три слоя, причем относительное число катионов в каждом из них может значительно варьировать. Глинистые минералы из рек и озер явно отличаются по своему составу от глинистых минералов океанского дна. Почти все речные и озерные воды, особенно соприкасающиеся в обширных бассейнах рек с мергелями и известняками, насыщены кальцием. Эта так называемая жесткая вода выщелачивает из кристаллической решетки глинистых минералов натрий и магний. Минералы, таким образом, распадаются. Попадая в морскую воду, которая из-за высокого содержания Na может считаться щелочной, они "восстанавливаются", т. е. натрий и магний опять входят в кристаллическую решетку. Именно из-за этой способности глинистых минералов терять и присоединять некоторые катионы в зависимости от состава воды они и обладают буферным действием.
Схема реакций разрушенных глинистых минералов с морской водой такова. Вначале происходит интенсивный обмен катионами. Кальций, обычно преобладающий в глинистых минералах речного происхождения над другими катионами, замещается Na+, Mg2+ и K+. Кроме того, восстанавливаются иллит и хлорит, в которых из катионов оставался только алюминий. В их кристаллические решетки включается калий или магний (или оба эти катиона). Наконец, считается возможной и третья реакция - образование новых, так называемых аутигенных глинистых минералов при соединении веществ, растворенных в пресной и морской воде [19].
Например, реакция между кальдиевым речным и натриевым океаническим монтмориллонитом протекает согласно следующему уравнению:
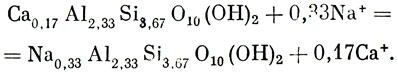
Реакция восстановления (воссоединения) распавшихся алюмосиликатов идет следующим образом:
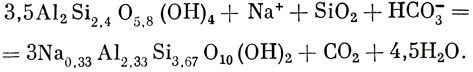
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'