
2. Алкены
Углеводороды ряда алкенов отличаются от алканов тем, что каждый углеводород этого ряда содержит двойную связь, как в этилене. Поэтому их общая формула CnH2n. Если удалить из метана два атома водорода, образовался бы весьма реакционноспособный короткоживущий метиленовый бирадикал
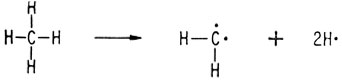
При рекомбинации двух метиленовых бирадикалов возникает углерод-углеродная двойная связь, т. е. образуется молекула этилена
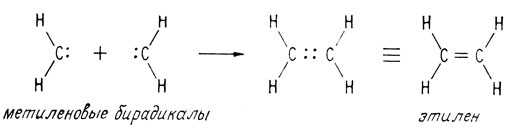
Как было указано выше, двойная связь в этилене состоит из σ- и π-связей, причем π-связь слабее, чем σ-связь. Это следует из того, что энергия связи для простой связи углерод-углерод составляет 83 ккал/моль, тогда как полная энергия всей углерод-углеродной двойной связи равна лишь 142 ккал/моль. Хотя все двойные связи состоят из σ- и π-связей, их почти всегда изображают в виде двух линейных связей, соединяющих атомы.
В табл. 5 приведены некоторые алкены с двойными связями, соединяющими первый и второй атомы углерода цепи (концевые двойные связи). Из данных табл. 5 следует, что температуры кипения алкенов возрастают с увеличением числа атомов углерода в цепи. Может происходить, конечно, и разветвление цепи. Появление внутренних (неконцевых) двойных связей приводит к образованию геометрических изомеров.
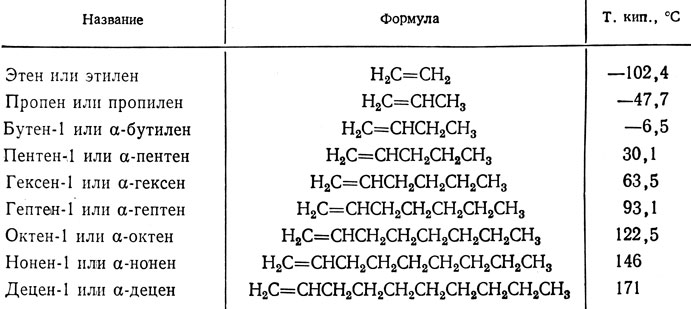
Таблица 5. Неразветвленные алкены-1*
* (Цифра, стоящая после названия, указывает, у какого атома углерода находится двойная связь. Согласно другой системе обозначений положение двойной связи между первым и вторым атомами углерода обозначают буквой α.)
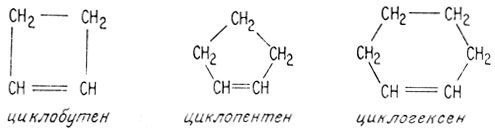
а. Диены и циклические соединения. Соединения, содержащие две углерод-углеродные двойные связи, называются диенами, содержащие три углерод-углеродные двойные связи - триенами и т. д. Могут существовать также циклические соединения с двойными связями.
б. Бензол и резонанс. Молекула бензола по существу представляет собой циклогексатриен
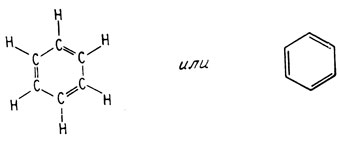
Однако это соединение гораздо более стабильно, чем можно было предсказать, основываясь на приведенной формуле. В этом соединении мы встречаемся с делокализацией π-электронов, образующих двойную связь между атомами углерода. Делокализация электронов такого типа называется резонансом. Специфическая стабильность, обусловленная резонансом, связана с размазыванием электронной плотности, в результате которой высвобождается энергия. Структуру бензола можно изобразить в виде двух форм:
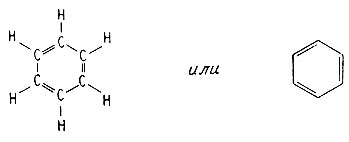
В действительности молекула существует не в виде одной из этих форм, а скорее в виде промежуточной структуры между ними. Все углерод-углеродные связи в бензоле равноценны, так же как и связи углерод-водород.
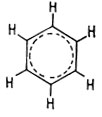
Пространственное изображение структуры бензола показано на рис. 9.
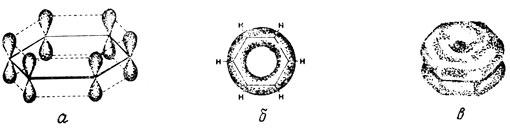
Рис. 9. Схематическое изображение делокализации π-электронов в молекуле бензола. а - взаимодействие π-орбиталей; б - вид сверху на делокализованные орбитали; в - изображение делокализованных орбиталей при взгляде сверху и сбоку от плоскости σ-связей
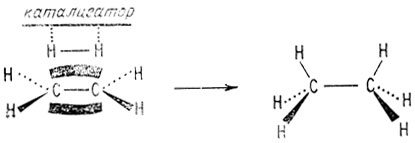
Алкены в присутствии катализатора могут реагировать с водородом, образуя алканы. Эти реакции гидрирования происходят вследствие как слабости π-связи, так и пространственной доступности π-электронов. Например, этилен присоединяет водород (гидрируется), образуя этан.
Для бензола можно оценить количество энергии, выделяемой за счет резонансной стабилизации, сравнивая теплоту гидрирования бензола, при которой образуется циклогексан, с теплотой гидрирования обычной "локализованной" двойной связи, например двойной связи этилена. При гидрировании обычной двойной связи выделяется почти 30 ккал энергии на 1 моль. При гидрировании трех двойных связей выделилось бы 90 ккал. При гидрировании бензола выделяется только 50 ккал. Это означает, что три делокализованные двойные связи в бензоле почти на 40 ккал прочнее, чем три обычные локализованные двойные связи. Эти 40 ккал и представляют энергию стабилизации бензола.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'