
Телеметрия и телестимуляция мозга (Ж. Дельгадо)
Применение вживленных в мозг электродов позволило осуществить электрическое раздражение и регистрацию активности мозга ненаркотизированных животных, что дало важную информацию о физиологической основе поведения. Однако в этих экспериментах животное приходилось соединять с аппаратурой проводами, что ограничивало его подвижность, часто являлось причиной изменений в его поведении и почти сводило на нет возможность изучения групп животных. Поведение животных в сообществе можно считать одним из важнейших проявлений деятельности мозга, которое до сегодняшнего времени нейрофизиологи почти не могли исследовать из-за отсутствия необходимых методов. Поэтому нам очень мало известно о том, какие области мозга ответственны за поведение животных в сообществе, за взаимную привязанность и антагонизм. Последние достижения в области радиотехники позволили обеспечить двустороннюю беспроводную связь между испытуемым и экспериментатором, что, несомненно, будет способствовать значительному расширению и углублению нашего понимания нейрофизиологической основы поведения индивида и группы.
Так как главной темой этой конференции является телеметрия, мы хотим подчеркнуть, что для понимания физиологии поведения животных телестимуляция играет такую же важную роль, как и телерегистрация данных. Оба метода тесно связаны и взаимно дополняют друг друга. В идеале мы должны уметь выполнять ряд следующих операций, не касаясь подопытного животного и не тревожа его:
А. Телерегистрация: 1) электрических проявлений биологической активности (ЭЭГ, ЭКГ и миограммы); 2) биохимических проявлений активности животного (изменение концентрации ионов, выделение ацетилхолина и других веществ); 3) физических переменных, относящихся к биологической активности (кровяное давление, дыхание, температура и двигательная активность); 4) поведения, как индивидуального, так и в сообществе, для получения количественных, качественных, временных и пространственных характеристик.
Б. Телестимулядия: 1) электрическое раздражение отдельных областей мозга, нервов и других тканей; 2) инъекция химических соединений для возбуждения, торможения или изменения функций определенных структур; 3) разрушение тканей посредством электролиза или химических веществ.
В этой статье мы обсудим разработанные нами методы телерегистрации химических изменений, двигательной активности животных и их поведения, а также методов электрической и химической телестимуляции мозга.
В качестве введения полезно, быть может, кратко рассмотреть некоторые физиологические аспекты деятельности мозга.
Некоторые важные функциональные характеристики мозга
При изучении электрической и биохимической активности мозга ненаркотизированных животных были использованы, главным образом, стереотаксические методы и методы вживления электродов и канюлей [47].
Общепризнано, что мозг животного и человека толерантен к присутствию нержавеющей стали и других инертных материалов, таких, как тефлон и нейлон, в течение месяцев и даже лет. В наших экспериментах вокруг вживленного электрода наблюдалась некоторая реакция глии, но уже на расстоянии примерно 0,5 мм от электрода никаких гистологических или функциональных изменений не наблюдалось; поэтому можно было считать неискаженной как спонтанную и вызванную электрическую активность, так и ответную реакцию на электрическое раздражение в течение всего времени имплантации электрода - что для одной из наших обезьян составило 4 года.
С точки зрения получения нужного воздействия очень важную роль играют физические характеристики раздражения. В целом импульсы длительностью менее 1 мсек более эффективны и менее вредны, чем более долгие импульсы. Форма импульсов (прямоугольная или экспоненциальная), по-видимому, не имеет большого значения. Катодное раздражение более эффективно, чем анодное; при длительном раздражении импульсы с переменной полярностью следует предпочитать импульсам одной и той же полярности во избежание явлений электролиза. Важную роль играет частота импульсов, так что, меняя частоту, можно в одной и той же точке мозга получить разные реакции. В целом для изучения поведения лучше всего подходит частота 100 гц. Изучение автономных эффектов часто требует более низких частот.
Повторное раздражение мозга не вызывает гистологических поражений при условии, что используются соответствующие параметры раздражения. Кратковременное раздражение вызывало в некоторых экспериментах длительные эффекты. Например, раздражение миндалевидного ядра кошки в течение 5 сек вызывало анорексию, продолжавшуюся 3 дня [25]. В некоторых областях мозга, например в двигательной области коры, после нескольких секунд раздражения отмечалось утомление, так что для восстановления возбудимости этого участка ему необходимо было дать отдых в течение примерно 1 мин. Однако другие области, например гипоталамус, сохраняют способность реагировать в течение всего времени раздражения (так, реакцию сокращения зрачка можно вызывать в течение нескольких дней без признаков утомления). Прямое раздражение определенных структур мозга может дать огромное разнообразие соматических, спонтанных и поведенческих реакций - от простых движений до сложной последовательности действий, включающих обучение, обусловливание и (у людей) изменения в процессах мышления и памяти, а также появление галлюцинаций, усиливающуюся дружелюбность и вербализацию.
Значительная часть работы по изучению функций ненаркотизированного мозга уже проделана, но эта область все еще остается одним из наиболее обещающих отделов нейрофизиологии: как уже было сказано, изучение поведения в сообществе с помощью телестимуляции открывает широкое и относительно мало исследованное поле деятельности.
Методы телестимуляции
Методы раздражения мозга на расстоянии описаны у нескольких авторов [5, 6, 12, 23, 28-30, 33, 39, 43 и 49]. Применяемые раздражители можно разделить на две группы, а именно: вживляемые под кожу и прикрепляемые к животному снаружи при помощи различных приспособлений.
Главные преимущества вживления телеприемников состоят в том, что при этом: а) отсутствуют провода и б) прибор находится в безопасности, так как обезьяна не может его достать. Однако этот метод обладает и рядом недостатков: а) обычно можно раздражать только одну точку мозга; б) контроль раздражения затруднен или невозможен; в) интенсивность раздражения неопределенна, так как она зависит от посылаемого сигнала и от ориентации приемной антенны; г) нельзя регистрировать электрическую активность мозга.
Приемники на перевязи используются в сочетании со вживленными в мозг электродами, которые имеют на конце прикрепленное к черепу гнездо, торчащее из кожи (фиг. 1). Преимущества этого метода таковы: а) в каждом эксперименте может быть использован любой из нескольких вживленных контактов; б) интенсивность раздражения может устанавливаться заранее и не меняется в течение эксперимента; в) прибор может быть легко удален, проверен, заменен или отремонтирован; г) ограничив свободу передвижения животных, раздражение можно контролировать и регистрировать.
![Фиг. 1. Обезьяна через 5 месяцев после вживления в мозг 28 электродов [10]. В задней части головы видны два небольших гнезда, наполовину скрытых шерстью](pic/000189.jpg)
Фиг. 1. Обезьяна через 5 месяцев после вживления в мозг 28 электродов [10]. В задней части головы видны два небольших гнезда, наполовину скрытых шерстью
Последние достижения в технологии электронных приборов и миниатюризации позволяют легко уменьшить размеры и вес стимуляторов, приемников и батарей, что представляло собой серьезную проблему несколько лет назад. Главное неудобство стимуляторов, укрепленных на перевязи, состоит в том, что обезьяны, особенно если их много и они могут помочь друг другу, обладают настоящим талантом по части исследования и разрешения приборов, которые находятся в пределах их досягаемости. К счастью, возможность поместить батареи и электронные части в капсулы из эпоксидной смолы делает эти приборы практически неуязвимыми, так как единственными доступными частями остаются антенна и отведение на выходе. Антенны, хотя бы незначительно выступающие из кожи, непрактичны, так как они легко могут быть погнуты и поломаны. Предпочтительнее использовать антенные катушки в капсулах, но если антенна все же необходима, следует скрыть ее в перевязи. Близость к телу животного увеличивает флуктуационные шумы в антенне, снижая ее чувствительность, что, однако, можно легко компенсировать увеличением силы посылаемого сигнала. Стремление инженеров к миниатюризации стимуляторов должно сопровождаться попытками нейрофизиологов уменьшать, насколько это возможно, интрацеребральные электроды и гнезда. Некоторые авторы пользуются укрепляемыми на черепе приспособлениями [47], которые могут изменять картину поведения животного. Использование миниатюрных гнезд, подобных показанному на фиг. 1, позволяет увеличивать число отведений без увеличения веса соединений, причем новые типы еще меньших гнезд с большой плотностью контактов (например, пробка Кэннона) позволят провести дальнейшее уменьшение габаритов.
В целях безопасности следует связать стимулятор с гнездом в голове с помощью подкожного соединения. Во время вживления электродов в мозг мы прокладываем под кожей животного от головы к спине тонкую полиэтиленовую трубочку, через которую потом очень просто продеть провод или заменить его, если он ломается в длительных опытах. В некоторых экспериментах мы пользовались для интрацеребральных контактов подкожным гнездом (фиг. 2). Оно сделано из кусочка люцита, из которого выходят отведения, оканчивающиеся в ртутных колодцах, закрытых резиновой мембраной. После вживления отведений в мозг и закрепления гнезда в черепе кожа над гнездом полностью закрывается. Позднее контакт с любым из ртутных колодцев устанавливается путем введения в колодец с помощью иглы тонкого провода с тефлоновой изоляцией, зачищенного на конце. Провод проходит через кожу и резиновую мембрану, причем его можно оставлять внутри колодца в течение часов и дней, если сделать на конце провода маленький крючок; по желанию провод удаляется легким рывком.
![Фиг. 2. Подкожно имплантируемое гнездо из люцита [19]. Ртутные колодцы 3 закрыты резиновой диафрагмой 1 и связаны с выводом каждого интрацеребрального электрода 4. Люцитовое гнездо прикрепляется к крыше черепа 6 тефлоновыми винтами 2. Кожа 5 закрывается над гнездом. Для соединения с гнездом в колодец с помощью тонкой иголки вводят (через кожу и резиновую диафрагму) провода с тефлоновой изоляцией](pic/000190.jpg)
Фиг. 2. Подкожно имплантируемое гнездо из люцита [19]. Ртутные колодцы 3 закрыты резиновой диафрагмой 1 и связаны с выводом каждого интрацеребрального электрода 4. Люцитовое гнездо прикрепляется к крыше черепа 6 тефлоновыми винтами 2. Кожа 5 закрывается над гнездом. Для соединения с гнездом в колодец с помощью тонкой иголки вводят (через кожу и резиновую диафрагму) провода с тефлоновой изоляцией
Кожа большинства животных весьма чувствительна к постоянному давлению, и плохо подогнанная перевязь может вызвать изъязвление и инфекцию. Необходимо специально обратить внимание на то, чтобы равномерно распределить вес прибора и избежать слишком тесной перевязи. В этом случае удобно пользоваться "правилом большого пальца", которое состоит в следующем: одеваемые на животных воротники и пояса должны быть подогнаны таким образом, чтобы между ними и кожей животного свободно проходил большой палец.
Стимулятор на транзисторах
Для раздражения биологических тканей можно с успехом применять целый ряд схем. Показанная на фиг. 3 схема почти полностью подобна другой, ранее описанной схеме [13] и использовалась в большей части наших экспериментов. Габариты прибора 3×1×1 см, вес 10 г, он стоек при ударах, прост, надежен и недорог. Мультивибратор на двух транзисторах работает на частоте 100 гц, которую можно легко менять, изменяя величины соответствующих сопротивлений и конденсаторов. Выпрямление производится посредством диода, выход регулируется вручную с помощью потенциометра сопротивлением 5000 ом, для установки которого существует специальная шкала (единственная в приборе).
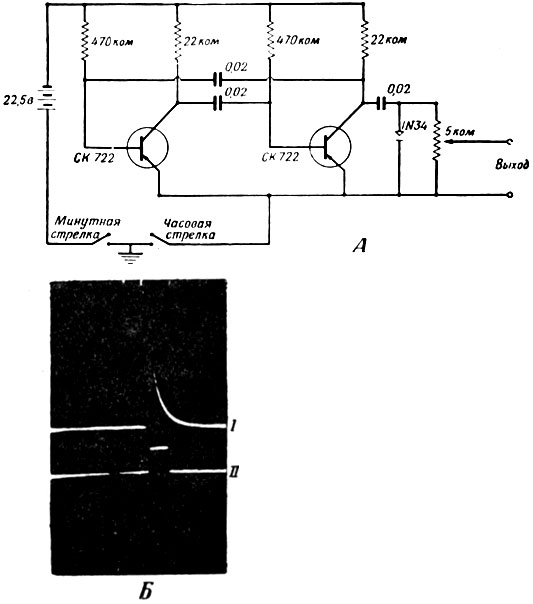
Фиг. 3. Схема стимулятора на транзисторах (А) и форма импульсов, генерируемых при максимальном напряжении 20 в (Б, кривая I). Кривая II - прямоугольный импульс длительностью 0,1 мсек, генерируемый стимулятором Грасса
Как показано на фиг. 3, Б, импульсы имеют экспоненциальный фронт, причем их длительность равна 0,1 мсек. Необходимую энергию дает батарея напряжением 22,5 в фирмы "Бурджес". Этот основной стимулятор можно запускать либо вручную - для раздражения животных, ограниченных в свободе передвижения, либо, если животные могут свободно двигаться, с помощью миниатюрного датчика времени (фиг. 4) или приемника на радиочастотах (фиг. 5 и 6).

Фиг. 4. Программирование раздражения с помощью модифицированных ручных часов. Диапазон раздражения неограничен и не зависит от радиосигналов. При раздражении обонятельной борозды открывается рот и поворачивается голова, но общение между животными не нарушается

Фиг. 5. Колония обезьян, к каждой из которых прикреплен приемник радиосигналов, осуществляющих раздражение мозга (частоты сигналов для всех обезьян различны)

Фиг. 6. Результаты раздражения бахромы свода. Обезьяна очень быстро бегает и ворчит, однако увеличения агрессивности не наблюдается
Миниатюрный программирующий механизм
Для создания программирующего механизма мы воспользовались небольшими противоударными ручными часами, в которые внесли следующие изменения: в ось секундной и часовой стрелок ввели крошечные колесики из плексигласа с маленькими контактами в осях. Один контакт был рассчитан на замыкание в течение 5 сек, а другой - в течение 1 час. Контакты заземлялись на корпус часов с помощью крошечных волосков расщепленной рояльной струны, вмонтированных в пластмассовые стерженьки. Соответствующие комбинации секундных и часовых шестеренок и заземленных контактов позволили установить следующие программы раздражения: 1) 5 сек каждую минуту в течение 1 час каждые 12 час; 2) непрерывно на 5 сек каждую минуту в течение суток; 3) непрерывно в течение 1 час с заранее определенным началом и концом раздражения и 4) непрерывное раздражение. Другие программы можно установить, меняя размеры и число контактов в плексигласовом колесике.
Как показано на фиг. 5, реле времени и стимулятор вмонтированы в воротник, одеваемый на шею животного. Преимуществами этого метода являются малые размеры и вес прибора, отсутствие шумов в контактах и неограниченная подвижность животного. В качестве недостатков следует упомянуть, во-первых, тот факт, что программа стимуляции устанавливалась заранее, так что ее нельзя было менять, не беспокоя животное; во-вторых, в длительных экспериментах часы надо было заводить каждые 36 час (для этого пользовались самозаводящимися часами); в третьих, цикл стимуляции повторялся каждые 12 час. В случае необходимости можно было изменить цикл, меняя шестеренки, связанные с часовой стрелкой часов. Результаты опытов, проведенных по этой методике, были опубликованы [11, 13-17].
Управление раздражением по радио
Проблема, общая для всех методов управления на расстоянии, описанных в литературе, заключается в том, что интенсивность раздражения мозга зависит от мощности принимаемого сигнала, которая в свою очередь зависит от ориентации приемной антенны, расстояния от источника излучения, заземления животного и экранирования укрепленного на животном приемника различными объектами (скажем, стенками клетки или другими животными). Эти трудности легко преодолеть, если приемник используется только для того, чтобы замкнуть контакт, запускающий стимулятор, мощность которого устанавливается перед экспериментом. В этом случае допустимы изменения мощности радиосигналов в широких диапазонах, причем схема и конструкция передатчика и приемника значительно упрощаются. Другое преимущество заключается в том, что подходящие для наших исследований приборы можно достать по умеренным ценам, так как их применяют для управления полетами моделей самолетов. Сейчас мы пользуемся улучшенным вариантом приемника марки Venus, размеры и вес которого уменьшены за счет миниатюрных катушек и реле.
Чувствительность приемника колеблется от 2 до 4 мкв; он работает на напряжении 3 в и частоте 27 Мгц, потребляет ток 3 ма на холостом ходу и примерно 40 ма - для включения электромагнитного контакта. Передатчики и приемники имеют кварцевую стабилизацию, и любой из 6 обезьян колонии можно наносить раздражение независимо от остальных.
На фиг. 5 приведена фотография нескольких обезьянок с приемниками, а на фиг. 6 показаны результаты электрического раздражения бахромы свода. При этом была достигнута повышенная активность животного; обезьяна ворча бросалась от одной стенки к другой, не набрасываясь, однако, на других обезьян.
При управляемом на расстоянии раздражении различных структур мозга наблюдалось как усиление общения между животными, так и, напротив, угрожающее поведение и попытки нападать на других обезьян и, наконец, эффекты, не связанные с поведением животных в сообществе, например хождение по клетке и карабканье на стены, потеря равновесия и многие другие реакции [18, 19, 25].
Хемитроды для перфузии и стимуляции мозга
В работах некоторых авторов описаны методы введения химических препаратов в мозг ненаркотизированных животных [1, 4, 9, 22, 24, 31, 32, 34-38, 40-42, 44, 48, 50]. Эти методы основываются на вживлении в мозг канюли, через которую можно вводить в мозг твердые вещества или жидкие растворы.
Другие авторы производили перфузию желудочков мозга, имплантируя две отдельные канюли [2, 45]. Предложенная рядом авторов [20, 26, 27] имплантация двойной канюли позволяет собирать перфузионную жидкость после того, как она омыла ткани мозга. Мы создали прибор, который позволяет осуществить перфузию и одновременно посылать и принимать электрические сигналы. С помощью этого прибора, названного нами "хемитродом" (что означает "химический путь"), можно исследовать отдельные области мозга. Он представляет собой совокупность двух трубочек из нержавеющей стали 0,41 мм в диаметре и изолированного тефлоном провода из нержавеющей стали диаметром 0,12 мм (конец его длиной 1 мм зачищен).
Для применения хемитродов в опытах со свободно передвигающимися животными был разработан управляемый по радио хемитродный насос. Он состоит из двух камер, сделанных из люцита и разделенных эластичной мембраной. Одна камера заполняется синтетической спинномозговой жидкостью или инъецируемой жидкостью, а в другой содержится раствор гидразина. Проходящий через вторую камеру электрический ток вызывает выделение газа, давление которого проталкивает через хемитроды жидкость, содержащуюся в первой камере, и инъецирует ее в мозг. Скорость введения жидкости зависит от силы тока и может меняться от 1 мл за 10 мин до 1 мл за 10 час и более. При телеуправлении насосом включение и отключение проходящего через гидразин тока производится с помощью реле радиоприемника, подобного тому, который использовался для запуска описанного выше электрического стимулятора. Размеры насоса 4 × 1,8 см, весит он (без жидкостей) всего 10 г.
Для сбора жидкостей после циркуляции их в мозгу свободно передвигающегося животного был построен хемитродный коллектор, представляющий собой гибкий мешочек, защищенный пластмассовым щитком. Мешочек прикрепляется к выходу хемитрода с помощью полиэтиленовой трубочки, причем пластмассовый щиток снабжается клапаном для компенсации изменений объема мешочка. Коллектор прикрепляется к ошейнику животного рядом с хемитродным насосом. Другие детали и результаты эксперимента можно найти в опубликованной ранее работе [18].
Телеметрия поведения животных в сообществе
Для регистрации деятельности отдельных животных разработан ряд методов, основанных на применении фотоэлементов, изменении емкости в зависимости от близости животного и переключении микровыключателей, расположенных на полу клетки, а также различные варианты этих методов. Таким способом было изучено влияние различных лекарственных препаратов и электрического раздражения мозга [7, 8, 21].
Однако все эти методы непригодны для анализа активности нескольких животных, входящих в состав колонии, так как они не дают возможности однозначно отождествлять движения каждого животного.
Несмотря на это, такие исследования представляют для нас большой интерес. Влияние лекарственных препаратов или электрического раздражения может сказаться на отношении подопытного животного к остальной части группы, а часто и на поведении всей колонии. Вдобавок некоторые вещества могут оказывать различное и подчас даже противоположное воздействие на изолированное животное и на животное, входящее в группу [3]. Телеметрия движений позволяет зарегистрировать поведение каждого подопытного животного и проанализировать воздействие лекарственных веществ и других экспериментальных раздражителей как на уровне отдельной особи, так и на уровне группы.
На фиг. 7 показана разработанная нами схема передатчика на одном транзисторе [20]. Прибор имеет следующие характеристики: вес - 14 г; общее потребление тока при напряжении 9 в - 1,8 ма; частота настройки - 85-115 Мгц; достигаемая с большой надежностью дальность действия без антенны, связанная только с излучением катушки, - 15 м в помещении; размеры передатчика, заключенного в капсулу с эпоксидным наполнителем, - 2,5 см в длину и 2 см в диаметре. Устойчивость частоты наблюдается при температуре от 10 до 27°, что не хуже или даже лучше, чем у большинства приемников. Срок службы батареи при непрерывной работе - 72 час, а с инерционным выключателем 30 дней или больше.
![Фиг. 7. Схема передатчика с блоком частотной модуляции (А) и схематическое изображение инерционного ртутного выключателя (Б) для регистрации подвижности одной особи [20]. 1 - эпоксидный наполнитель; 2 - нержавеющая сталь; 3 - изолирующая шайба](pic/000195.jpg)
Фиг. 7. Схема передатчика с блоком частотной модуляции (А) и схематическое изображение инерционного ртутного выключателя (Б) для регистрации подвижности одной особи [20]. 1 - эпоксидный наполнитель; 2 - нержавеющая сталь; 3 - изолирующая шайба
В начале нашей работы над передатчиком для регистрации движений животного мы пользовались медным шариком в пластмассовой груше, помещенным в катушку передатчика. Изменения в положении шарика изменяли частоту излучения. К сожалению, ввиду непрерывной работы передатчика срок службы батареи не превосходил 72 час, а так как ловить животное каждые 3 дня было совершенно нецелесообразно, мы сконструировали инерционный выключатель, возбуждающий передатчик только тогда, когда животное двигалось. Выключатель, как показано на фиг. 7, был сделан из двух кусков нержавеющей стали, имевших наклон от края к середине под углом 4°; они соединялись изолирующими шайбами из фибергласа и полностью погружались в эпоксидный наполнитель. Нормальное положение выключателя - открытое; закрытое же положение (которое длилось максимум 0,2 сек) имело место в том случае, когда капля ртути, перекатываясь из одного угла в другой, замыкала контакт в середине. При любом положении капли контакт не мог быть постоянно закрытым. Выключатель не обладал чувствительностью к легким движениям животного, например поворотам головы или руки, но возбуждался при любой смене положения животного или при его перемещении. Напряжение батареи равнялось 9 в, ее размеры - 4 см в длину и 1,3 см в диаметре; она весила 19 г и также была полностью залита эпоксидной смолой. Передатчик, инерционный выключатель и батарея были надежно вмонтированы в кожаный пояс, застегнутый у бедер животного (фиг. 8).

Фиг. 8. Передатчик, сигнализирующий о движениях обезьяны, укреплен на ее поясе. Для раздражения мозга могут использоваться дополнительные воротники. Таким образом, между экспериментатором и подопытным животным устанавливается двусторонний контакт
Передатчики перестраивались с частоты любой радиопередающей станции на нужную частоту после прикрепления к обезьяне. Каждому животному соответствовала своя длина волны. В качестве приемника был выбран имеющийся в продаже недорогой приемник для частотно-модулированных сигналов марки "Realistic". Приемник был настроен на сигналы в диапазоне ±50 кгц от несущей частоты передатчика. Сигнал с выхода дискриминатора усиливался и поступал на реле, сигнал которого включал счетчик. В одних экспериментах счетчики фотографировались каждые 30 мин, в других - каждые 4 час.
Для настройки аппаратуры каждый день в 8 час утра обезьян три раза прогоняли из одного угла клетки в другой, и счетчики регистрировали общее число движений. Эта процедура повторялась три раза. Несмотря на некоторые отклонения в реакции животных и на различия в длине прыжков, контрольные цифры в разные дни и для разных животных в среднем составляли 100-200 движений. Если получались заниженные цифры, то соответствующую обезьяну отлавливали для проверки настройки передатчика и приемника.
Спонтанная подвижность и воздействие хлорпромазина
Изучение влияния хлорпромазина на спонтанное поведение животных проводилось на колонии обезьян, в которую входили обезьяна № 5 (самка, 5,1 кг), обезьяна № 6 (самка, 4,5 кг) и обезьяна № 3 (самец, 4,6 кг), перечисленные в порядке уменьшения эффекта. При дальнейших исследованиях в колонию добавили еще двух обезьян. Животные находились в клетке размером 2,1 × 1 × 1 м со стеклянной передней стенкой для проведения наблюдений и фотографирования, освещенной неоновыми лампами, которые давали яркость света в 13 единиц по фотометру Вестона.
Смена 12-часовых периодов дня и ночи (8 час. утра до 8 час. вечера) осуществлялась автоматически с помощью реле времени. Вся клетка помещалась в звуконепроницаемой комнате с кондиционированным воздухом, которую можно было наблюдать через окно, пропускающее свет только в одном направлении. Считалось, что обезьяна не проявляет активности, когда не было зарегистрировано ни одного движения по крайней мере в течение 10 мин. Обычно число движений в активные периоды колебалось от 400 до 600 в час; иногда, в периоды резко повышенной активности, оно достигало 2000 в час. Запись движений в течение 24 час показана на фиг. 9, где можно видеть тесную корреляцию между периодами активности и бездействия для всех трех обезьян. Каждый день через 5-10 мин после включения света в 8 час. утра все обезьяны начинали бурно двигаться, что длилось еще 2 или 3 час. Каждый день все обезьяны от 3 до 8 раз в день одновременно прекращали движения на 15-30 мин. Когда в 8 час. вечера выключался свет, деятельность животных продолжалась, обычно без перерыва и с той же интенсивностью, еще в течение часа-двух. Большую часть ночи обезьяны были не активны, хотя и наблюдались отдельные вспышки движений и несколько коротких периодов общей активности.

Фиг. 9. Регистрация движений трех обезьян в течение 24 час (для каждой обезьяны предназначен отдельный канал). Можно видеть, что периоды активности и покоя у всех трех животных совпадают
Эти характеристики достаточно точно описывали поведение животных в течение 30 дней контрольных наблюдений. Общее число движений для каждого животного менялось в разные дни в умеренных пределах: от 8000 до 14000 для обезьяны № 5; от 5000 до 12000 для обезьяны № 6 и от 5000-9000 для обезьяны № 3. В целом все животные обнаруживали одинаковые тенденции к увеличению или уменьшению подвижности.
Для проверки влияния хлорпромазина одну из обезьян поймали в 9 час. 30 мин. утра и внутримышечно ввели ей 0,75 мг/кг хлорпромазина, после чего животное немедленно возвратили в колонию. С интервалом в несколько дней этот эксперимент был повторен на других двух обезьянах с одинаковыми результатами. В течение первых часа-двух спонтанная активность животного не менялась, но затем наблюдалось явное снижение активности; по сравнению с контролем общая дневная активность инъецированного животного уменьшалась примерно втрое. Это продолжалось в течение почти 48 час и оказывало заметное влияние на остальных животных, так что общая активность колонии в этот период была ниже нормы (фиг. 10).
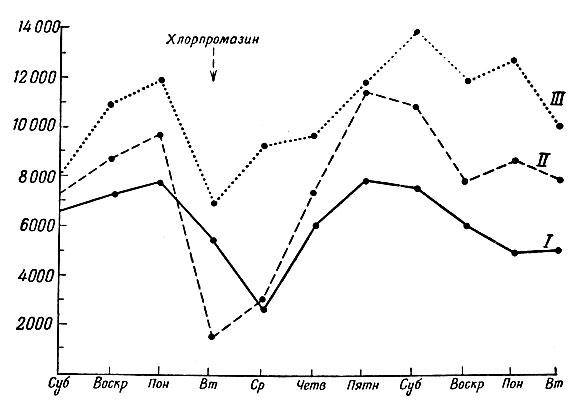
Фиг. 10. Воздействие хлорпромазина (0,75 мг/кг) на подвижность обезьян. Наибольшие изменения в поведении наблюдаются у инъецированного животного (кривая II), но известное воздействие хлорпромазин оказывает и на двух других членов колонии. Можно отметить продолжительное уменьшение подвижности. По оси ординат отложено общее число движений за 24 час, по оси абсцисс - дни недели
Телерегистрация поведения посредством цейтрафферной съемки
Электронная техника вполне пригодна для телерегистрации некоторых черт поведения животного, например его двигательной активности, но для регистрации специфических черт поведения (скажем, рычания, игры или половой деятельности) лучше применять цейтрафферную съемку. При этом обходятся трудности, связанные с электрической регистрацией, и не нужно беспокоить животное. Результаты опытов, касающиеся частоты съемки, длительности каждой экспозиции, ночных съемок с инфракрасной пленкой, классификации категорий поведения, автоматического анализа кинопленки, важности пространственных и временных факторов, диапазона вариабильности спонтанного поведения, воздействия различных химических веществ и т. п., опубликованы в других наших работах [18, 46].
Данные съемок, проводимых одновременно с телеметрической регистрацией активности, позволили установить корреляцию между движениями. Наибольшее число движений всегда наблюдалось одновременно у двух или трех обезьян и соответствовало "игре" животных, гоняющихся друг за другом, таскающих друг друга за хвосты или затевающих шутливые драки. Периоды бездеятельности в течение дня соответствовали сну всей колонии, когда животные обычно обнимают друг друга, удобно устраиваясь вместе. Ночью обезьяны обычно находятся в этом же положении, за исключением случайных периодов, когда они лежат на полу. Короткие промежутки ночной активности были связаны с хождением по клетке или легкими движениями тела. Половая деятельность ночью никогда не наблюдалась.
Литература
1. Adam H. M., Mc Kail R. A., Obrador S., Wilson W. C., Acetylcholine in the cerebro-spinalfluid, J. Physiol., 93, 45-46 (1938).
2. Bhattacharya В. K., Feldberg W., Perfusion of the ventricular system of the brain in the anesthetized cat, J. Physiol., 135, 4P (1957).
3. Brown В. B., Psychopharmacology: Problems in evaluation. Nat. Acad. Sci. Nat. Res. Council Publ., № 583, p. 236, 1959.
4. Bures J., Krivanek J., Ionic movement in the brain as studied with the aid of washing the cortical surface with an epidural cannula. Physiol, abstr., Bohemoslovenica, 9, 488-493 (1960).
5. Chaffee E. L., Light R. V., A method for the remote control of electrical stimulation of the nervous system. I. The history of electrical excitation., Yale J. Biol. Med., 7, 83-128 (1934-1935).
6. Clark S. L., Ward J. W., Electrical stimulation of the cortex cerebri of cats: Responses elicited in chronic experiments through implanted electrodes, Arch. Neurol. Psychiat., Chicago, 38, 927-943 (1937).
7. Cole J., Glees P., Some effects of methyl-phenidate (ritalin) and amphetamine on normal and leucotomized monkeys, J. ment. Sci., 103, 406-417 (1957).
8. Davis G. D., Effects of central excitant and depressant drugs on locomotor activity in the monkey, Amer. J. Physiol., 188, 619-623 (1957).
9. Delgado J. M. R., Cerebral structures involved in transmission and elaboration of noxious stimulation, J. Neurophysiol., 18, 261-275 (1955).
10. Delgado J. M. R., Evaluation of permanent implantation of electrodes within the brain, EEG clin., Neurophysiol., 7, 637-644 (1955).
11. Delgado J. M. R., Prolonged stimulation of brain in awake monkeys, J. Neurophysiol., 22, 458-475 (1959).
12. Delgado J. M. R., A transistor timed stimulator, EEG clin. Neurophysiol., 11, 591-593 (1959).
13. Delgado J. M. R., Electronic command of movement and behavior, Trans. N. Y. Acad. Sci., 21, 689-699 (1959).
14. Delgado J. M. R., Modification of social behavior induced by remote-controlled electrical stimulation of the brain. XXI int. Congr. physiol. Sci. Abstracts., p. 75, 1959.
15. Delgado J. M. R., Emotional behavior in animals and humans, Psychiat. Res. Rep., 12, 259-271 (1960).
16. Delgado J. М. R., Brain and social behavior in the monkey, Fed. Proc., 19, 286 (1960).
17. Delgado J. M. R., Chronic implantation of intracerebral electrodes in animals. Pp. 25-36 in: Electrical Stimulation of the Brain, D. E. Sheer (ed.) Austin: Univ. Texas Press, 641 pp., 1961.
18. Delgado J. M. R., Pharmacological modifications of social behavior. 1st. int. Congr. Pharmacolog., Stockholm, Pergamon Press, 1962.
19. Delgado J. M. R., The effect of brain stimulation on taskfree situations. Int. Neurophysiol, Symp., Mexico City, October 1961, 1962.
20. Delgado J. M. R., Stolwijk J. A. J., Telemetring of movement in monkey colonies, 1962.
21. Dews P. B., The measurement of the influence of drugs on voluntary activity in mice, Brit. J. Pharmacol., 8, 46-48 (1953).
22. Feldberg W., Sherwood S. L., A permanent cannula for intraventricular injections in cats, J. Physiol., 120, 3P-5P (1953).
23. Fender F. A., Epileptiform convulsions from "remote" excitation, Arch. Neurol. Psychiat., Chicago, 38, 259-267 (1937).
24. Fisher A. E., Maternal and sexuel behavior induced by intracranial chemical stimulation, Science, 124, 229 (1956).
25. Fonberg E., Delgado J. M. R., Avoidance and alimentary reactions during amygdala stimulation, J. Neurophysiol., 24, 651-664 (1961).
26. Fox R. H., Hilton S. M., Bradykinin formation in human skin as a factor in heat vasodilatation, J. Physiol., 142, 219-232 (1958).
27. Gaddum J. H., Push-pull cannulae, J. Physiol., 155, 1P-2P (1961).
28. Gengerelli J. А., Kallejian V., Remote stimulation of the brain in the intact animal, J. Physiol., 29, 263-269 (1950).
29. Gengerelli J. A., Remote brain stimulation and relationships between parameters of stimulation and learning. Pp. 155-164 in: Electrical Stimulation of the Brain, D. E. Sheer (ed), Austin Texas, Univ. Texas Press, 641 pp., 1961.
30. Greer M. A., Riggle G. C., Apparatus for chronic stimulation of the brain of the rat by radiofrequency transmission, EEG. chin. Neurophysiol., 9, 151-155 (1957).
31. Haley T. J., Dasgupta S. R., intracerebral injection of lysergic acid diethylamide in conscious dogs and cats, Arch. int. Pharmacody, 113, 296-301 (1957-1958).
32. Haley T. J., McCormick W. G., Pharmacological effects produced by intracerebral injection of drugs in the conscious mouse, Brit. J. Pharmacol., 12, 12-15 (1957).
33. Harris G. W., The innervation and actions of the neurohypophysis; an investigation using the method of remote-control stimulation, Phil. Trans. B., 232, 385-441 (1946-1947).
34. Heath R. G., Founds W., A perfusion cannula for intrecerebral microinjections, EEG, clin. Neurophysiol., 12, 930-932 (1960).
35. John E. R., Tschirgi R. D., Wenzel В. M., Effects of injections of cations into the cerebral ventricles on responses in the cat, J. Physiol., 146, 550-562 (1959).
36. Kobajashi T., Drug administration to cerebral cortex of freely moving dogs, Science, 135, 1126-1127 (1962).
37. Leusen I., Influence de le teneur en calcium et en potassium du liquide cfiphalorachidien sur le systfem vasomoteur, Arch, int. pharmacaayn., 75, 422 (1948).
38. Lilly J. C., Electrode and connulae implantation in the brain by a simple percutaneous method, Science, 127, 1181-1182 (1958).
39. Loucks R. B., A technique for faradic stimulation of tissues beneath the integument in the absence of conductors penetrating the skin, J. comp. Psychol., 18, 305-313 (1934).
40. Mac Lean P. D., Chemical ans electrical srtimulation of hippocampus in unrestrained animals, Arch. Neurol. Psychcat., Chicago, 78, 113-127 (1957).
41. Mac Lean P. D., Delgado J. M. R., Electrical and chemical stimulation of fronto-temporal portion of limbic system in the waking animal, EEG clin. Neurophysiol., 5, 91-100 (1953).
42. Masserman J. H., Effects of sodium amytal and other drugs on the reactivity of the hypothalamus of the cat, Arch. Neurol. Psychiat., Chicago, 37, 617-628 (1937).
43. Mauro A., Davey W. L. M., Scher A. M., Central nervous stimulation by implanted heigh frequency receiver, Fed. Proc., 9, 86 (1950).
44. Olds J., Olds M. E., Positive reinforcement produced by stimulating hypothalamus with iproniazid and other compounds, Science, 127, 1175-1176 (1958).
45. Pappenheimer J. R., HeiseyS. R.f Exchange of materials between cerebrospinal fluid and blood, 1962.
46. Delgado R. R., Delgado J. M. R., An objective approach to measurement of behavior, Phil. Sci., 1962.
47. Scheer D. E. (Ed.), Electrical Stimulation of the Brain. Austin. Texas: Univ. Texas Press, 1641, pp., 1961.
48. Trzebski A., The action of adrenaline, noradrenaline and monamine oxidase inhibitors injected directly into the reticular formation of the brain stem, Bull. Acad. pol. Sci., 8, 525-528 (1960).
49. Verzeano M., French J. D., Transistor circuits in remote stimulation, EEG clin, Neurophysiol., 5, 613-616 (1953).
50. Vogt M., Gunn G. G., Sawyer С. H., Electroencephalographs effects on intraventricular 5-HT and LSD in the cat, Neurology, 7, 559-566 (1957).
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'