
Глава III. Конверсия световой энергии биокаталитическими системами (биофотолиз воды)
Анализ долговременных тенденций в развитии энергетики (см. гл. I) показывает, что в ближайшие десятилетия будет возрастать роль водорода как топлива для нужд промышленности, транспорта, технологии производства пищевых продуктов. Концепция солнечно-водородной энергетики предполагает разработку и освоение способов конверсии световой энергии в топливную форму. Наиболее перспективна в этом плане реакция фотолиза воды с образованием молекулярного водорода и запасанием энергии в виде энергии химической реакции его окисления.
Разложение воды на водород и кислород с помощью световой энергии может осуществляться различными путями. Предполагается, что принципиально возможен сенсибилизированный органическими или неорганическими пигментами фотолиз воды. Энергия кванта красного видимого света (1,7 эВ) достаточна для переноса электрона против термодинамического потенциала от воды на уровень водорода (1,2 эВ). Возможно, что окажется целесообразным получение водорода в комплексных системах фотоэлектрического и электрохимического характера. Разработка высокоэффективных фотовольтаических преобразователей позволила бы получать водород на последующей электрохимической стадии и осуществить таким образом фотоэлектролиз воды.
Принципиально новую возможность открывает использование для целей разложения воды на водород и кислород биологических систем. Речь идет о применении для получения водорода природного фотосинтеза при соответствующем направлении механизма реакций, имеющих место в фотосинтетическом аппарате растений, микроскопических водорослей или фототрофных бактерий, на преимущественное выделение молекулярного водорода [73, 157, 158, 393, 394].
Фотосинтез в целом как природный феномен - достаточно сложное явление. Исследование механизма превращения световой энергии при фотосинтезе составляет большой раздел современной биофизики, который весьма интенсивно развивается в последние десятилетия [398]. Условно сложную цепь стадий в механизме фотосинтеза подразделяют на первичные и вторичные процессы. Под первичными процессами фотосинтеза обычно понимают совокупность фотофизических, фотохимических и химических стадий, связанных с индуцированным светом разделением элементарных зарядов и переносом электронов. Вторичные стадии представляют собой биохимические реакции, заключающиеся в использовании возникающих на первичных стадиях сильных восстановителей, например, в восстановлении углекислоты до углеводов [395-398]. С точки зрения реакций биофотолиза воды интерес представляет анализ как первичных, так и вторичных процессов. Однако в первую очередь эффективность фотосинтеза определяют первичные стадии.
Фундаментальными положениями о функционировании фотосинтетического аппарата являются понятия о фотосинтетической единице и реакционном центре фотосинтеза. Фотосинтетическая единица представляет собой единую систему светосборщиков - пигментов и ферментов, осуществляющих поглощение и миграцию световой энергии, реакции переноса электронов и темновые реакции [399-401]. Квант света, поглощенный какой-нибудь молекулой пигмента фотосинтетической системы за счет миграционных процессов электронного возбуждения, приводит в возбуждение молекулу пигмента в реакционном центре.
Реакционные центры представляют собой специфические образования пигмент-белковой природы, в которых происходит первичное разделение зарядов. Экспериментальным обоснованием существования реакционных центров, в которых молекула пигмента способна претерпевать под действием света обратимые окислительно-восстановительные превращения, послужили данные Кока, который методом дифференциальной спектроскопии при интенсивном освещении обнаружил небольшие спектральные изменения при 700 нм у растений и 870-890 нм у пурпурных бактерий. Наиболее детально исследованы реакционные центры пурпурных бактерий. Пигмент-белковые комплексы, содержащие реакционноспособный пигмент, удалось выделить [402-404]. По Клайтону полученные препараты реакционных центров состоят из белка с молекулярным весом 60-70 тыс., с которым связаны две молекулы бактериофеофетина и несколько молекул бактериохлорофилла.
Первичный фотохимический акт фотосинтеза заключается в разделении зарядов в реакционном центре. При использовании лазерной импульсной техники показано [398] в случае бактериального фотосинтеза, что этот процесс представляет собой окисление фотовозбужденного бактериохлорофилла с переносом электронов на акцептор неизвестной природы. Можно думать, что в качестве такого акцептора выступает некая электроноакцепторная группа белка реакционного центра [402-404].
Принципиальным вопросом является квантовая эффективность процессов поглощения света и первичного разделения зарядов. Миграция электронного возбуждения в светособирающей фотосинтетической антенне с эффективностью, близкой к 100%, приводит к возбуждению молекулы пигмента реакционного центра [405], за которым следует первичное разделение зарядов. Квантовый выход этого процесса близок к единице. Например, квантовая эффективность фотоокисления бактериохлорофилла в реакционных центрах Rhodopseudomonas sp. была найдена равной 1,02±0,04 [406]. Константа скорости разделения зарядов весьма высока и превышает 1011 с-1 [405]. В то же время процесс рекомбинации возникшей пары электрон - дырка очень медленный. Природа кинетического барьера, обеспечивающего такую эффективность первичного разделения зарядов, является одной из основных проблем в исследовании молекулярного механизма фотосинтеза и в настоящее время еще не достаточно понята. Непрерывный характер процесса в стационарном режиме обеспечивается достаточно быстрым каталитическим восстановлением окисленной формы пигмента реакционного центра, осуществляемого с помощью белковых переносчиков электрона. При этом в бактериальном фотосинтезе первичным донором электронов служат различного рода органические соединения, в растительном фотосинтезе и в фотосинтезе с участием микроскопических водорослей - вода.
Фундаментальной особенностью биоэнергетических механизмов в целом и механизма фотосинтеза в частности является широкое использование стадий одноэлектронного переноса по цепям переносчиков белковой природы. В значительной степени пониманию механизма фотосинтеза способствовало изучение цепи переноса электронов в первичных стадиях фотосинтеза.
Детальное экспериментальное исследование фотосинтеза у высших растений и микроскопических водорослей показало, что механизм переноса электронов от воды включает по крайней мере две фотохимические стадии. Основой для этого вывода послужили исследования спектров действия фотосинтеза [407-409]. При использовании монохроматического света длиной волны 700 нм и более практически прекращается выделение кислорода фотосинтезирующими системами. Если система дополнительно освещается монохроматическим лучом более короткой длины волны, выход фотосинтеза резко возрастает, причем скорость выделения кислорода при совместном освещении превышает сумму скоростей выделения кислорода при одноволновом освещении.
Эти опыты послужили основой постулирования в механизме фотосинтеза двух фотосистем (фотосистема I и фотосистема II), различающихся по спектрам действия и механизму функционирования. Каждая фотосистема представляет собой структурноорганизованную фотосинтетическую единицу, включающую 100-800 молекул пигмента фотосинтетической антенны, реакционный центр с фотохимически активным пигментом и необходимый набор белковых переносчиков электрона. Молекулы пигмента в реакционных центрах спектрально различаются (Р700 для фотосистемы I и Р690 для фотосистемы II [410, 411]). Далее в результате тонкого биохимического исследования удалось получить препараты, обогащенные фотосистемами I и II [412-416]. Оказалось, что фракция, обогащенная фотосистемой I, активно восстанавливала под действием света НАДФ при использовании в качестве донора электронов восстановленного дихлорфенолиндофенола; фракция, обогащенная фотосистемой II, обладала способностью фотовосстанавливать различные органические красители с выделением кислорода
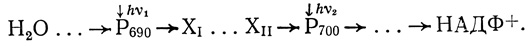 (3.1)
(3.1)В дальнейшем было показано, что фотосинтетическая единица фотосистемы I хлоропластов шпината содержит около 450 молекул хлорофилла а и хлорофилла b, фотосинтетическая единица фотосистемы II - около 60 молекул [417].
Принципиально важным шагом было обнаружение того, что коротковолновая и длинноволновая подсветка систем осуществляет окислительно-восстановительные превращения переносчиков электрона в противоположных направлениях. Так, в работах [412, 419] показано, что коротковолновая подсветка приводит к восстановлению цитохрома f, а длинноволновая сопровождается окислением цитохромов f и с. Аналогично, при освещении системы светом, поглощаемым фотосистемой I, можно наблюдать окисление цитохрома b6 [420], пластохинона и пластоцианина [421-423]. Функционирование фотосистемы II приводит к восстановлению этих переносчиков электронотранспортной цепи.
На основе богатого экспериментального материала в работе [424] предложена схема электронотранспортных процессов фотосинтеза, объясняющая наблюдаемые экспериментальные данные (рис. 28).
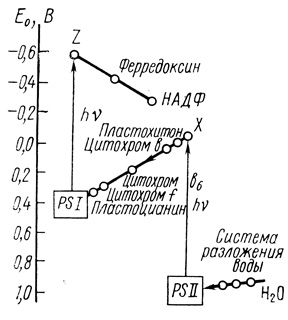
Рис. 28. Схема электронотранспортных процессов в фотосинтезе
Обсуждение Z-схем электронного транспорта дано в ряде обзоров [398, 425, 426]. Основные результаты проведенного анализа можно суммировать следующим образом. Перенос электронов в механизме фотосинтеза растениями и микроскопическими водорослями осуществляют две спектрально и функционально различные системы. Поглощение кванта света фотосинтетическими пигментами фотосистемы II вызывает ионизацию молекулы пигмента в реакционном центре фотосинтеза. В результате первичного воздействия света происходит окисление пигмента и перенос электрона против термодинамического потенциала на первичный акцептор фотосистемы II. В работе [427] измерена величина окислительно-восстановительного потенциала первичного акцептора. Квантовая эффективность фотовосстановления первичного акцептора, а также его окисления при действии фотосистемы предельна и равна единице [428].
Предполагается, что окисленная форма пигмента в реакционном центре является достаточно сильным окислителем, способным в результате ряда каталитических превращений окислить воду с образованием молекулярного кислорода. Механизм процесса "сложения" электронных вакансий и четырехэлектронного окисления воды без образования активных промежуточных радикалов не достаточно ясен, однако интенсивно исследуется в последние годы [429-431]. Для этой цели фотосинтезирующие структуры содержат полиферментную систему катализаторов переносчиков электрона (система разложения воды). Каталитический перенос электрона от воды на окисленную форму фотосинтетического пигмента регенерирует молекулу пигмента в реакционном центре фотосистемы II.
Электрон, акцептированный в процессе "элементарного" акта первичным акцептором электрона фотосистемы II в результате ряда последовательных термодинамически выгодных окислительно-восстановительных реакций, переносится на донор фотосистемы I. Перенос электронов с первичного акцептора фотосистемы II на донор фотосистемы I осуществляет ряд белковых переносчиков электрона. В этой цепи переноса электрона последовательно участвуют пластохинон, пластоцианин и цитохром f. Одну электронотранспортную цепь "обслуживает" около 10 молекул пластохинона, способных обмениваться электронами между собой. Механизм участия пластохинона в электронном транспорте обсуждается в работах [426, 432-435]. Предполагается, что обмен электронов между различными электронотранспортными цепями происходит с участием пластохинона [435], который является достаточно подвижным липофильным переносчиком.
Участие цитохрома f в электронном транспорте между фотосистемами обсуждается в работах [436-441], пластоцианина - в работе [442], цитохромов b и b6 - в работах [397, 441]. Возможно, что цитохром b6 участвует в циклическом транспорте электронов, являясь акцептором электронов из фотосистемы I и донором их в фотосистему II [442]. Осуществление циклического транспорта - необходимый элемент фотофосфорилирования [443-445].
Поглощение кванта света пигментной системой I вызывает ионизацию пигмента и перенос электрона на первичный акцептор фотосистемы I. Квантовый выход этой реакции близок к единице. Эта величина была получена при фотоокислении различных доноров электрона фотосистемой I [446]. Образовавшаяся электронная вакансия заполняется путем взаимодействия с донором электронов электронотранспортной цепи, действующей между двумя фотосистемами (см. рис. 28).
Первичный акцептор фотосистемы I - достаточно сильный восстановитель (Е0 (pH 7,0) около - 600 мВ), способный восстанавливать ферредоксин и также некоторые низкопотенциальные экзогенные акцепторы электрона [447-449].
Транспорт электронов на уровне восстановительной стороны фотосистемы I приводит к образованию соединений, обладающих низкими окислительно-восстановительными потенциалами. В электронотранспортную цепь после фотосистемы I входят переносчики электронов ферродоксин и ферредоксин-НАДФ-редуктаза. Функция этих соединений заключается в каталитическом восстановлении кофактора НАДФ, которое протекает с участием флавопротеида (НАДФ-редуктаза). Кофактор используется на последующих темновых стадиях для восстановления углекислоты до углеводов.
Таким образом, согласно изложенным представлениям освещение фотосинтетического аппарата, локализованного в биологических мембранах растений и микроводорослей, приводит к возникновению непрерывного потока электронов. На первичных стадиях фотосинтеза фотосинтетический аппарат работает как двухтактный "электронный насос", осуществляя перенос электронов от воды против термодинамического потенциала на соединения, близкие по электрохимическому потенциалу к водородному электроду. При этом согласно Z-схеме фотосинтеза на перенос одного электрона фотосинтетический аппарат затрачивает два кванта света. В этом плане задача фотосинтетического получения водорода сводится, в первую очередь, к организации каталитического процесса переноса электронов на протоны с образованием молекулярного водорода.
Схема процессов переноса электрона, (см. рис. 28) - в достаточной степени устоявшаяся модель первичных процессов фотосинтеза. В литературе существуют различные модификации и усложнения этой схемы (см., например, работу [450]), однако основная совокупность данных, представляющих богатый экспериментальный материал исследования первичных процессов, достаточно хорошо описывается Z-схемой.
Процесс переноса электронов в мембранной системе хлоропластов и хроматофоров бактерий сопряжен с весьма важным процессом фотофосфорилирования. С точки зрения проблемы биофотолиза воды фотофосфорилирование - вторичный процесс, механизм которого не связан с генерацией свободной энергии, способной осуществить разложение воды. Достаточно сказать, что свободная энергия гидролиза АТФ составляет ∼0,3 эВ, в то время как необходимая разность потенциалов равна 1,3 эВ. Детальное обсуждение механизмов сопряжения фосфорилирования и электронного транспорта выходит за рамки настоящей работы. В этой области существуют весьма полные и исчерпывающие монографии и обзоры [28, 29, 451, 452].
Исследования последних нескольких лет показали, что реакцию фоторазложения воды на водород и кислород под действием света в достаточной степени эффективно можно проводить с участием биохимических полиферментных систем природного фотосинтеза [157, 158, 393]. Изучение физико-химических аспектов этой проблемы, с одной стороны, способствует детальному пониманию этого процесса, его оптимизации, определению теоретически возможных параметров, с другой стороны, создает условия для моделирования явления на уровне физических и химических систем.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'