
4. Кинетика инактивационных процессов в биокаталитических системах. Стабилизация систем биофотолиза воды
Фундаментальной особенностью систем с участием биокатализаторов и биомембран является их кинетическая нестабильность. Для биокатализаторов и биоструктур весьма характерно "старение", вызванное физико-химическими процессами денатурации белков и беомембран. Исследование потери биологическими молекулами или субмолекулярными образованиями их функциональной активности в процессе "старения" позволяет выявить причины, приводящие к функциональной инактивации, и тем самым выявить причины "старения".
Познание законов "старения" на уровне "молекулярной геронтологии" имеет важное значение для понимания механизма "старения" биологических объектов в целом. С другой стороны, при изучении инактивации биополимеров и их систем можно получить ценную информацию об их свойствах и механизмах биологических процессов. Именно поэтому в современной молекулярной биологии важное место занимают исследования денатурационных явлений биологических полимеров и субмолекулярных биологических структур. Наконец, непрерывно возрастает интерес к использованию уникальных свойств биополимерных молекул. Рассматриваемые в настоящей работе системы биофотолиза воды могут найти применение как преобразователи солнечной энергии при решении ряда фундаментальных проблем в области их стабилизации и увеличения времени активной работы. Альтернативным подходом, приводящим к конечной цели, представляется разработка высоковозобновляемых систем [460, 461].
В настоящей главе проведен анализ кинетических закономерностей и механизмов инактивации ферментов и полиферментных систем. Обычно процесс инактивации ферментов представляют в виде мономолекулярной реакции, протекающей с определенной частотой
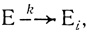 (3.57)
(3.57)где Е и Еi - каталитически активная и неактивная формы фермента соответственно.
В этом случае скорость инактивации пропорциональна концентрации активного фермента, и зависимость концентрации фермента от времени дается уравнением
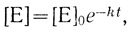 (3.58)
(3.58)где [Е]0 - концентрация фермента в начальный момент времени.
Нами проведен детальный анализ кинетических закономерностей инактивации составных элементов систем биофотолиза воды. Исследования проводили на уровне терминальных ферментов гидрогеназ [320, 321], электронотранспортных цепей изолированных хлоропластов [501, 502], клеток фотосинтезирующих организмов [503, 461]. Экспериментальное исследование этих систем обнаружило большое разнообразие кинетических закономерностей инактивации, далеко выходящее за рамки простого экспоненциального закона.
Особые проблемы возникают при инактивации полиферментных систем, объединенных в комплексы или иммобилизованных в биологической мембране в клетке. В этом случае физико-химическое изменение одного фермента, сопровождающее его инактивацию, в определенной степени может сказаться на стабильности других катализаторов. В системах с биомембранами происходит непрерывное изменение их свойств и соответственно изменение характеристик Процессов инактивации ферментов. Всю совокупность экспериментально наблюдаемых кинетических кривых инактивации можно классифицировать по следующим трем категориям.
Кинетические кривые, описываемые экспоненциальным законом. Кинетика инактивации дается экспоненциальной функцией (3.58), характеризуется константой скорости инактивации k. На рис. 42 приведены данные по кинетике инактивации гидрогеназы Thiocapsa roseopersicina на воздухе (кривая 2). Кинетическая кривая достаточно строго описывается уравнением (3.58) с k = 5,1⋅10-3 ч-1.
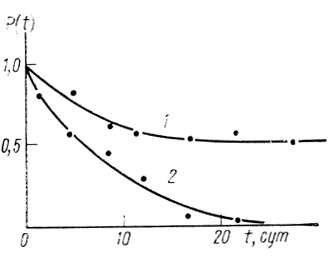
Рис. 42. Кинетика необратимой инактивации гидрогеназы Т. roseopersicina при инкубации фермента под разными газовыми фазами: 1 - аргон; 2 - воздух; pH 7,2; 0,067 М КН2РO4; 20°С
Сумма экспоненциальных членов. В большинстве случаев процесс инактивации может быть описан суммой экспонент. Например, кинетика инактивации Thiocapsa roseopersicina под аргоном (см. рис. 42, кривая 1) описывается суммой ух экспонент [321]. Аналогично, суммой двух экспоненциальных членов описывается кинетика инактивации электронотранспортной цепи хлоропластов [501, 502], рис. 43.
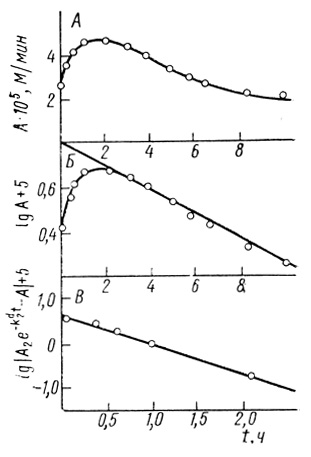
Рис. 43. Кинетические закономерности инактивации электронотранспортной цепи изолированных хлоропластов; pH 7,9; 20 мМ трис-НСl; 40 мМ КН2РO4; 10 мМ NaCl; 0,4 М сахарозы; 30°С. А - исходная кинетическая кривая; Б - определение τ2; В - определение τ1
Кинетические кривые инактивации с большими периодами индукции. В ряде случаев как при исследовании ферментов, так и ферментных систем в клетках, на кинетических кривых инактивации наблюдается ярко выраженный период индукции, в течение которого скорость инактивации близка к нулю и система практически стабильна. Однако в дальнейшем развитие процесса приводит к быстрой потере биокаталитической функции. Такого рода кривую иллюстрируют рисунок, на котором приведены данные по кинетике инактивации электронотранспортной цепи клеток синезеленых водорослей Anabaena variabilis (рис. 44). По аналогичному закону инактивируется гидрогеназа Al. eutrophus (рис. 45).
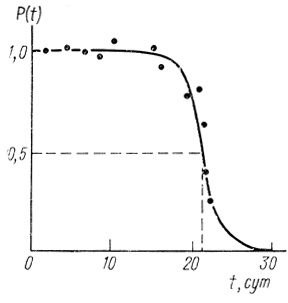
Рис. 44. Кинетика инактивации электронотранспортной цепи синезеленых водорослей Anabaena variabilis. Кривая имеет теоретический характер для нормального закона надежности при T0 = 21,5 сут, σ = 1,5 сут
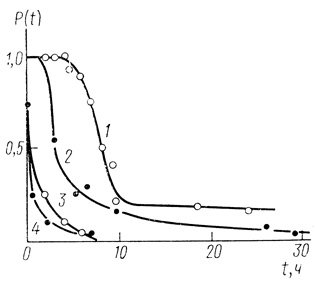
Рис. 45. Инактивация гидрогеназы Al. autrophus (pH 7,0; 0,05 М КН2РO4; 37°С). 1 - нативный фермент; 2 - в присутствии 10-2 М меркаптоэтанола; 4 - в присутствии 10-5 М НАДН
Возникает проблема количественного кинетического описания и анализа механизмов инактивации систем на основе единого подхода. Очевидно, физико-химическая концепция инактивационных процессов должна иметь достаточно общий характер.
В работах [504, 505] разработана кинетическая теория инактивационных процессов в биологических системах на основе использования представлений теории надежности. Представляется интересным применение элементов теории надежности, развитой для описаний общих закономерностей "старения" физических систем, для количественной характеристики "старения" биологических объектов.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'