
Молекулярная модель механизма катализа лакказой
Полученные результаты при сопоставлении с данными по составу и структуре активного центра лакказы могут дать картину молекулярного механизма восстановления кислорода с помощью данного фермента. Картина в определенной степени гипотетическая, однако создание такого типа молекулярных моделей на различных этапах исследования в высшей степени необходима.
В работах [551, 552] показано, что активный центр лакказы включает четыре иона меди трех типов. При этом два иона меди типа 3 объединены и могут представлять собой двухэлектронный донор - акцептор. Возможно, что ионогенные группы с рКа ∼ 5,5 представляют собой два основания, входящих в активный центр фермента. Этими основаниями могут быть имидазольные группы гистидина, аминогруппы лизина, аргинина или депротонированная форма карбоксильных групп дикарбоновых аминокислот. Структуру активного центра в этом случае можно представить в виде
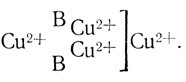
Возможная схема молекулярных превращений, происходящих в активном центре фермента в процессе каталитического акта восстановления кислорода, соответствующая кинетической схеме, представлена на рис. 88.
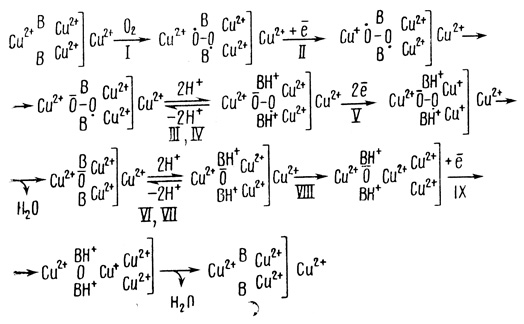
Рис. 88. Молекулярная модель катализа восстановления кислорода лакказой
Стадия II, представляющая собой одноэлектронное восстановление активного центра фермента, возможно, необходима для того, чтобы "упрочить" комплекс кислорода с активным центром. Стадии III, IV и VI, VII представляют собой стадии протонирования оснований, входящих в активный центр фермента. Два одинаковых, симметричных и синхронно работающих основания в механизме катализа оксидазой играют принципиально важную роль. С одной стороны, они в протонированной форме облегчают перенос электронов с донора (электрода) на двухэлектронный акцептор, с другой - ускоряют электронный транспорт и являются донорами двух протонов на стадии образования воды.
Из кинетических данных, полученных в настоящем исследовании, следует, что механизм катализа включает образование промежуточной частицы типа ЕО- (стадия V). Данная частица была зарегистрирована в независимых экспериментах при исследовании ЭПР-спектров фермента [556]. Это может служить одним из дополнительных подтверждений справедливости предложенной кинетической схемы и механизма.
Стадия VIII представляет собой некоторое структурное изменение активного центра фермента, возможно, конформационное изменение, т. е. стереохимическая замена двухэлектронного акцептора на одноэлектронный в непосредственной близости от активированного атома кислорода.
Таким образом, проведенное исследование кинетики катализа лакказой в электрохимическом режиме и в режиме изучения стационарной скорости окисления различных субстратов позволило постулировать детальную молекулярную картину действия катализатора.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'