
Опыт 9.1. Исследование реакции Хилла
Выделение хлоропластов
Материалы и оборудование
Листья шпината, салата или капусты
Ножницы
Предварительно охлажденная ступка с пестиком (либо гомогенизатор или бытовой миксер)
Марля или нейлон
Воронка для фильтрования
Центрифуга и центрифужные пробирки
Водяная баня со льдом и солью
Стеклянная палочка
Растворы (см. примечания ниже)
0,05 М фосфатный буфер, рН 7,0
Среда для выделения
Раствор ДХФИФ (реакционная среда)
Методика
Для выделения хлоропластов можно взять листья шпината, салата или капусты. Листья заливают холодной средой с нужным рН и подходящей осмотической и ионной силой; годится, например 0,4 М раствор сахарозы с 0,01 М КС1 и 0,05 М фосфатным буфером, рН 7,0. Если вы хотите сохранить биохимическую активность, все растворы и необходимые принадлежности надо предварительно охладить и всю работу проводить на холоде и как можно быстрее. Поэтому сначала хорошо разберитесь в методике, а затем уже подготовьте все оборудование.
Если нет возможностей для самостоятельного получения препаратов каждой группой студентов, этим методом можно выделить достаточное количество хлоропластов сразу для нескольких групп.
1. Измельчите ножницами три небольших листочка шпината, салата или капусты (средние жилки и черешки не берите). Залейте в холодную ступку или стакан гомогенизатора 20 мл охлажденной среды для выделения (если надо, пропорционально увеличьте объем измельченной массы и среды) и бросьте туда измельченные листья.
2. Быстро и энергично разотрите листья в ступке (или гомогенизируйте их около 10 с).
3. Положите на воронку четыре слоя марли или нейлона, смочите холодной средой для выделения.
4. Профильтруйте гомогенат через воронку. Фильтрат соберите в охлажденные центрифужные пробирки, помещенные в водяную баню со льдом и солью. Соберите края марли вместе и тщательно отожмите ее в пробирки.
5. Удостоверьтесь в том, что объем фильтрата во всех пробирках одинаков*.
* (Центрифужные пробирки всегда следует уравновешивать на весах. - Прим.. перев.)
6. Если ваша настольная центрифуга имеет всего одну постоянную скорость, центрифугируйте фильтрат в течение 2-5 мин (нужно, чтобы появился небольшой осадок, но время осаждения должно быть минимальным).
Если имеется настольная центрифуга, скорость которой можно менять, центрифугируйте фильтрат 1-2 мин при 100-200 g (g - ускорение силы тяжести). Надосадочную жидкость отцентрифугируйте еще раз в течение 5 мин при 1000-2000 g (этого времени достаточно для получения небольшого осадка хлоропластов).
7. Слейте надосадочную жидкость. Налейте в одну из пробирок примерно 2 мл среды для выделения и ресуспендируйте осадок с помощью стеклянной палочки. Полученную суспензию перелейте во вторую пробирку и повторите ресуспендирование. (Если работают несколько групп студентов, то можно налить во все пробирки по 2 мл среды для выделения и дать каждой группе по одной пробирке.)
8. Полученную суспензию хлоропластов держите в водяной бане со льдом и солью и используйте ее как можно быстрее.
Реакция Хилла
Теперь суспензию хлоропластов можно использовать для изучения реакции Хилла. Раствор ДХФИФ должен быть комнатной температуры. Подготовьте четыре пробирки (1-4) и налейте в них соответственно
1) 0,5 мл суспензии хлоропластов + 5 мл раствора ДХФИФ; оставьте пробирку на ярком свету;
2) 0,5 мл среды для выделения + 5 мл раствора ДХФИФ; оставьте пробирку на ярком свету;
3) 0,5 мл суспензии хлоропластов + 5мл раствора ДХФИФ; сразу же спрячьте в темное место;
4) прилейте к 5 мл дистиллированной воды 0,5 мл суспензии хлоропластов. Эта пробирка послужит цветным стандартом: она покажет, какой должна быть окраска суспензии после полного восстановления ДХФИФ. Через 15-20 мин запишите ваши наблюдения.
Если в лаборатории есть колориметр, то за ходом реакции можно проследить, отмечая уменьшение поглощения света красителем по мере изменения его окраски. В окисленном состоянии краситель синий, а в восстановленном бесцветный. В этом случае пробы 2 и 4 следует приготовлять прямо в кюветах колориметра. Поставьте красный (или желтый) светофильтр и установите прибор на ноль, взяв в качестве контроля кювету с пробой 4. Затем быстро приготовьте пробу 1, снимите для нее показания прибора и поставьте кювету с пробой 1 на яркий свет. Дальнейшие измерения делайте через каждые 30 с. Постройте график хода реакции. Как только реакция закончится, измерьте поглощение пробы 3. Самопроизвольное восстановление красителя можно оценить по пробе 2, при этом для установки колориметра на ноль берут в качестве контроля среду для выделения. В идеале для полного восстановления достаточно 10 мин.
Примечания
Приготовьте следующие растворы:
0,05 М фосфатный буфер, рН 7,0
Na2HPО4·12Н2О 4,48 г (0,025 М)
КН2РО4 1,70 г (0,025 М)
Доведите дистиллированной водой до 500 мл и поставьте в холодильник (0-4°С).
Среда для выделения
Сахароза 34,23 г (0,4 М)
КС1 0,19 г (0,01 М)
Растворите все в фосфатном буфере при комнатной температуре и доведите буфером до 250 мл. Держите среду в холодильнике при 0-4°С.
Раствор ДХФИФ (реакционная среда)
ДХФИФ 0,007-0,01 г (~ 10-4 М)
КС1 0,93 г (0,05 М)
Растворите в фосфатном буфере при комнатной температуре и доведите объем до 250 мл. Храните в холодильнике при 0-4°С. Используйте при комнатной температуре. (Хлорид калия - кофактор реакции Хилла.)
9.8. Заметили ли вы какие-нибудь изменения в пробирке 1?
9.9. Для чего были нужны пробирки 2 и 3?
9.10. Какие другие органеллы помимо хлоропластов могут, по вашему мнению, попасть в суспензию?
9.11. Из чего видно, что они не участвуют в восстановлении красителя?
9.12. Почему среду для выделения надо держать на холоде?
9.13. Для чего забуферивают среду для выделения?
9.14. Что служит а) донором и 6) акцептором электронов в реакции Хилла?
9.15. При реакции Хилла ДХФИФ действует на участке между X и ФС I в Z-схеме (рис. 9.15), и при этом выделяется кислород. Связана ли реакция Хилла с циклическим или с нециклическим фотофосфорилированием или же с тем и другим? Обоснуйте ваш ответ.
9.16. На рис. 9.16 показано, как выглядят хлоропласты после описанного выше опыта: вид но, к чему приводит перенос их из гипертонической среды выделения в гипотоническую реакционную среду.
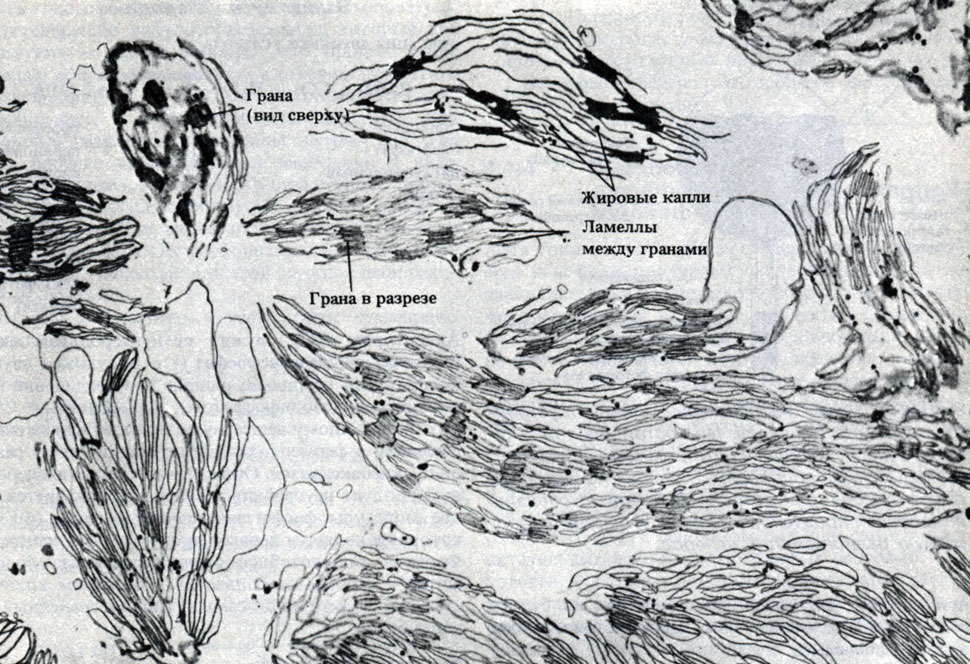
Рис. 9.16. Электронная микрофотография хлоропластов после выделения их в гипотонической среде; × 13485. Оболочки и строма утрачены
а) Чем хлоропласты на рис. 9.16 отличаются по внешнему виду от нормальных хлоропластов?
б) Можете ли вы объяснить, почему перенос хлоропластов в среду без сахарозы приводит к таким изменениям?
в) Почему желательно, чтобы эти изменения произошли в нашем опыте до реакции Хилла?
9.17. Как вы думаете, какое значение имело открытие реакции Хилла для понимания фотосинтетического процесса?
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'