
Глава 6
6.1. Избыток тепла необратимо изменяет вторичную и третичную структуру фермента. Это означает, что меняется характерная форма фермента и аминокислоты, обычно расположенные рядом друг с другом в функциональном активном центре, теряют свою взаимосвязь. Таким образом, активный центр становится нефункциональным. Как правило, конформация фермента легко нарушается при высоких температурах.
6.2. а) Сначала реакции А и В протекают быстро и образуется большое количество продукта. Затем образование продукта снижается и уже больше не повышается. Это может происходить вследствие того, что 1) весь субстрат перешел в продукт; 2) фермент инактивировался, или 3) достигнута точка равновесия обратимой реакции и субстрат и продукт присутствуют в сбалансированных концентрациях.
б) При повышении температуры 1) начальная скорость реакции увеличивается и 2) фермент становится менее стабильным и быстрее инактивируется.
в) Чувствительность к повышению температуры указывает на белковую природу фермента.
г) При низкой температуре (как в случае с кривой В) скорость образования продукта остается постоянной более 1 ч.
6.3. а) 5,50.
б) 1) пепсин; 2) амилаза слюны.
в) Разрушается активный центр фермента. Происходит модификация ионизируемых групп фермента, особенно тех, которые находятся в активном центре. Таким образом, субстрат более не укладывается в активном центре и каталитическая активность уменьшается.
г) Изменение рН приводит к изменению активности большинства ферментов. Скорость разных ферментативных реакций изменяется в разной степени, поскольку для активности каждого фермента характерен свой оптимум рН. Жизнь каждой клетки зависит от тонкой сбалансированности их ферментных систем, поэтому любое изменение ферментативной активности может вызвать гибель клетки или всего многоклеточного организма.
д) См. рис. 6.3 (отв.).
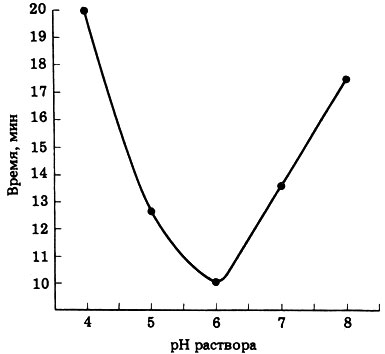
Рис. 6.3. (отв.). Активность каталазы, расщепляющей пероксид водорода при различных рН
Оптимум рН для фермента равен 6,00. При рН от 4 до 6 ионизируемые группы активного центра изменяются таким образом, что активный центр начинает более эффективно взаимодействовать и связываться с субстратом. При изменении рН от 6 до 8 происходит обратный процесс.
6.4. Увеличение концентрации субстрата приводит к тому, что вероятность попадания в активный центр оказывается больше у молекул субстрата, чем у молекул ингибитора.
6.5. Увеличение концентрации субстрата не влияет на общую скорость реакции, так как нет конкуренции за активный центр. Ингибирование, таким образом, необратимо.
6.6. а) В различных частях фермента расположены два центра: активный центр, связывающийся с веществом А, и другой центр, специфичный для связывания с X.
б) 1) X может ингибировать е1 и только в этом случае возможно образование продукта S по пути A-S. Эта ситуация сохраняется вплоть до исчерпания запасов X.
2) X мог бы ускорить каталитическую активность е5, вновь увеличивая образование S за счет X.
в) Ингибирование продуктом реакции.
г) Специфичность ферментов обусловливает тот факт, что на каждом этапе метаболического пути требуются свои ферменты. Это обеспечивает точную регуляцию обмена.
6.7. 1) Все они являются белками и синтезируются живыми организмами.
2) Они катализируют химические реакции, понижая энергию активации, необходимую для того, чтобы реакция началась.
3) Для протекания ферментативной реакции требуется очень небольшое количество фермента.
4) В конце реакции фермент остается неизмененным.
5) Каждый фермент специфичен и имеет активный центр, в котором фермент и субстрат, временно объединяясь, образуют фермент-субстратный комплекс. В результате диссоциации этого комплекса продукт высвобождается.
6) Ферменты работают лучше всего при оптимальных значениях рН и оптимальных температурах.
7) Будучи белками, ферменты денатурируют при экстремальных значениях рН и температуры.
8) Показатель Q10 ферментов в пределах температуры от 0 до 40°С приблизительно равен 2.
9) Некоторые ферменты активны в присутствии кофакторов.
10) Определенные химические вещества так же, как и конечные продукты метаболических путей, ингибируют активность ферментов.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'