
П.1.1.3. Ковалентные связи
При возникновении связей этого типа атомы, участвующие в их образовании, не отдают и не принимают электронов; вместо этого электроны оказываются поделенными (обобществленными) между двумя атомами. Представим себе два атома хлора. У каждого из них во внешней электронной оболочке имеется семь электронов (электронная конфигурация 2. 8. 7). При ковалентном связывании каждый из двух атомов хлора привносит в обобществленную пару электронов по одному электрону: образуется молекула хлора - С12. Таким путем оба атома приобретают электронную конфигурацию, приближающуюся к конфигурации благородного газа, и вместо ионов образуются молекулы (рис. П.1.2, В). Поделенную пару электронов принято обозначать как одинарную связь: С-С. Хлор одновалентен (т. е. обобществляет один из своих электронов). Другой пример - метан, СН4. Атомный номер углерода 6 и в его внешней электронной оболочке имеются 4 электрона (2. 4); водород (атомный номер - 1) имеет во внешней электронной оболочке только один электрон (рис. П.1.2, Г).
В молекуле этена (этилена), С2Н4, между углеродными атомами поделены две пары электронов и эти две пары представлены двойной связью (рис. П.1.2, Д). В некоторых соединениях, в частности в этине (ацетилене), С2Н2, имеется тройная связь, указывающая на три пары обобществленных электронов.
Ковалентные соединения встречаются в биологических системах гораздо чаще, чем ионные.
В табл. П.1.3 указаны валентности некоторых широко распространенных элементов и заряды часто встречающихся ионов.
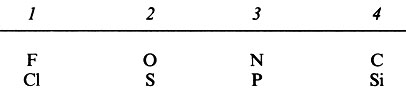
Таблица П.1.3. Валентность некоторых элементов и заряды некоторых ионов. А. Валентность некоторых элементов

Таблица П.1.3. Валентность некоторых элементов и заряды некоторых ионов. Б. Заряды некоторых ионов, состоящих из одного элемента
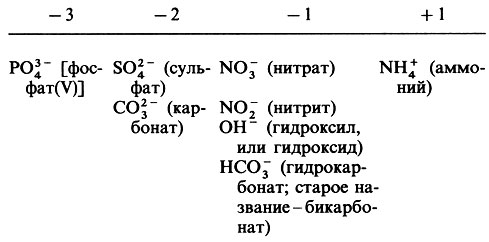
Таблица П.1.3. Валентность некоторых элементов и заряды некоторых ионов. В. Заряды некоторых ионов, состоящих из нескольких элементов
Формулы ковалентных соединений
Формулы простых ковалентных соединений указывают число атомов каждого типа, присутствующих в данной молекуле; так, формула СО2 (диоксида углерода) показывает, что в этой молекуле один атом углерода соединен с двумя атомами кислорода.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'