
17.4.2. Поперечнополосатые мышцы
Поперечнополосатая мышца состоит из множества функциональных единиц - мышечных волокон, или мышечных клеток*. Они имеют цилиндрическую форму и расположены параллельно друг другу. Это многоядерные клетки 0,01-0,1 мм в диаметре, достигающие нескольких сантиметров в длину. Ядра в волокне расположены около его поверхности. Пучки мышечных волокон окружены коллагеновыми волокнами и соединительной тканью; между волокнами тоже находится коллаген. На конце мышц коллаген вместе с соединительной тканью образует сухожилия, которые служат для прикрепления мышц к разным частям скелета. Каждое волокно окружено мембраной - сарколеммой, которая по своему строению очень сходна с обычной плазматической мембраной.
* (Строго говоря, мышечное волокно - не отдельная клетка, а результат слияния многих клеток, т.е. синцитий.- Прим. ред.)
В мышечных волокнах содержится большое количество миофибрилл (от греч. mys - мышца), которые и создают характерную поперечную исчерченность. Каждая миофибрилла состоит из белковых нитей двух типов - актиновых и миозиновых. Между миофибриллами находится множество митохондрий. Цитоплазма мышечного волокна называется саркоплазмой и содержит сеть внутренних мембран - саркоплазматический ретикулум. Поперек волокна и между миофибриллами проходит система трубочек, называемая Т-системой, которая связана с сарколеммой (рис. 17.15). В определенных местах трубочки Т-системы располагаются между двумя цистернами саркоплазматического ретикулума. Комплекс из одной Т-трубочки и двух цистерн называется триадой. Трубочка и цистерны соединены между собой поперечными мембранными мостиками. Цистерны участвуют в захвате и высвобождении ионов Са2+. В результате концентрация этих ионов в саркоплазме снижается или увеличивается, что в свою очередь влияет на активность АТФазы, а значит, и на сократительную функцию мышечного волокна.
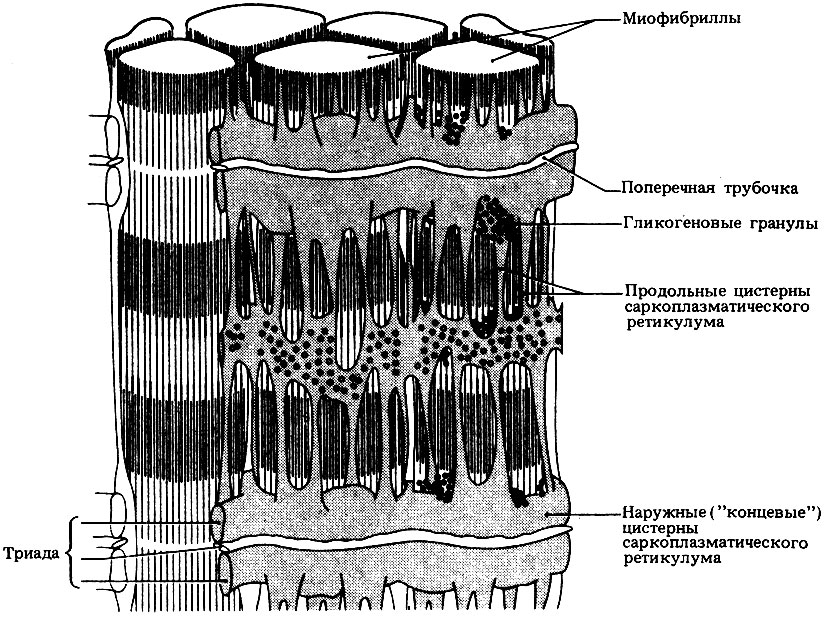
Рис. 17.15. Саркоплазматический ретикулум и Т-система
В световой микроскоп видна лишь поперечная исчерченность миофибрилл. Это выглядит как правильное чередование светлых и темных полос, названных соответственно зонами (или дисками) I и А. По середине каждой зоны проходит тонкая темная линия. Электронно-микроскопическое исследование ясно показывает, что исчерченность обусловлена определенным расположением нитей актина (тонких филаментов) и миозина (толстых филаментов). Это схематически представлено на рис. 17.16.
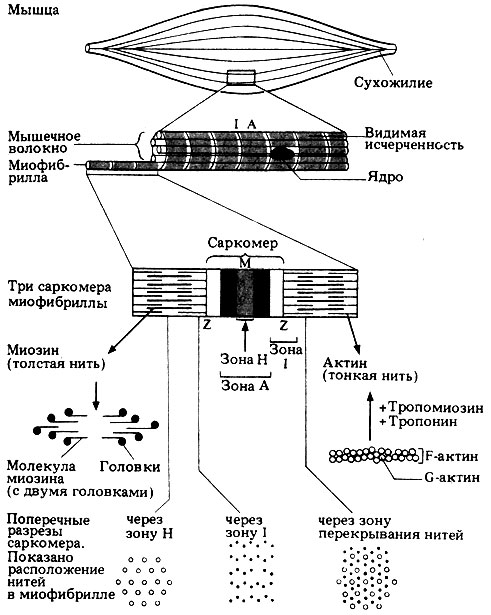
Рис. 17.16. Ультраструктура скелетного мышечного
Зона I разделена на две половинки темной линией Z. Участок миофибриллы между двумя линиями Z называется саркомером. В обе стороны от линии Z отходят актиновые нити, а в середине саркомера находятся миозиновые нити. Все они лежат параллельно друг другу, образуя, как видно на поперечном срезе, гексагональную решетку (рис. 17.17. и 17.18). В определенных участках саркомера актиновые и миозиновые нити перекрываются; в этих участках вокруг одной миозиновой нити размещаются шесть актиновых. Такое взаиморасположение миофиламентов приводит к появлению в саркомере нескольких дисков (полос). Там, где актиновые и миозиновые нити перекрываются, они образуют диск А, в то время как в районе диска I находятся только актиновые нити. Средняя часть зоны А более светлая; она называется зоной Нив свою очередь может подразделяться надвое линией М, которая делит миозиновые нити на две равные части.

Рис. 17.17. Продольный срез мышечного волокна рыбы (плотвы, Rutilus rutilus). Видны триады и детали строения миофибрилл. х 7650

Рис. 17.18. Летательная мышца насекомого (клопа белостомы). Поперечный срез волокна в состоянии окоченения (х 137000)
Миозин (толстые филаменты)
Молекула миозина состоит из двух частей: длинного палочкообразного участка ("хвоста") и присоединенного к одному из его концов глобулярного участка, который представлен двумя одинаковыми "головками". Молекулы миозина расположены в миозиновой нити таким образом, что головки регулярно распределяются по всей ее длине, кроме небольшого срединного участка, где их нет ("голая" зона). В тех местах, где нити актина и миозина перекрываются, миозиновые головки могут прикрепляться к соседним актиновым нитям, и в результате этого взаимодействия может происходить укорочение мышцы. Энергия для совершения такой работы высвобождается при гидролизе АТФ; все миозиновые головки обладают АТФазной активностью. Как мы увидим дальше, прикрепление миозиновых головок зависит от концентрации ионов Са2+ в саркоплазме. Миозиновая АТФаза активируется при взаимодействии актина с миозином. Ионы Mg2+ могут ингибировать этот процесс. Значение описанных явлений станет ясным, когда мы рассмотрим механизм сокращения саркомера.
Актин (тонкие филоменты)
Каждая актиновая нить образована двумя спиральными тяжами из глобулярных молекул актина (G-актина), закрученными один вокруг другого. Весь комплекс актиновых молекул называется F-актином (фибриллярным актином). Как полагают, с каждой молекулой F-актина связана молекула АТФ. Ни одна из форм актина не обладает АТФазной активностью.
Актиновые филаменты состоят из F-актина и двух вспомогательных белков - тропомиозина и тропонина. Тропомиозин-палочкообразный фибриллярный белок, и эти палочки соединяются конец в конец и образуют два тяжа, закрученные в виде растянутой спирали вокруг F-актина. Тропомиозин служит для включения и выключения сократительного механизма. Тропонин-глобулярный белок, состоящий из трех субъединиц. Каждая субъединица выполняет определенную функцию. Тропонин Т связывает тропонин с тропомиозином; тропонин С чувствителен к ионам Са2+ и может обратимо присоединять их, тогда как тропонин I способен ингибировать всякого рода взаимодействие между актином и миозином. Оба вспомогательных белка подавляют взаимодействие актина с миозином в отсутствие ионов Са2+ (рис. 17.19).
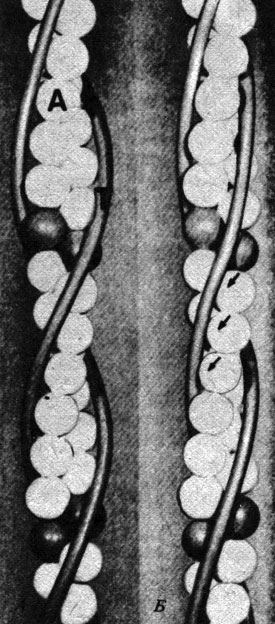
Рис. 17.19. Изменение структуры актиновых нитей. А. 'Выключенное' состояние при низком уровне Са2+; тропомиозин блокирует участки связывания миозина с актином. Б. 'Включенное' состояние при высоком уровне Са2+: тропомиозин смещается, обнажая участки связывания с миозином (указаны стрелками). А - актин; Т - тропомиозин. Тропонин не показан: он расположен ближе к субъединицам актина, изображенным серыми
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'