
Глава 25. Возбудители холеры
Вид Vibrio cholerae относится к семейству Vibrionaceae, роду Vibrio.
Возбудители холеры представлены двумя биоварами. Биовар V. cholerae выделен и изучен Р. Кохом (1883) и биовар eltor выделен Ф. Готшлихтом (1906). В течение длительного времени биовар Эль-Тор не считали возбудителем холеры. В 1962 г. по решению ВОЗ он был признан биоваром вибриона холеры.
В последнее время из воды и других объектов внешней среды выделены НАГ-вибрионы, которые еще не получили окончательного наименования, но их роль в острых кишечных заболеваниях установлена. Природа НАГ-вибрионов изучается. По морфологическим, культуральным и ферментативным свойствам они не отличаются от холерных вибрионов, имеют с ними общий Н-антиген. О-антигены у них разные. По О-антигену установлен 60 О-групп НАГ-вибрионов.
Морфология. Холерные вибрионы - небольшие (1-3 × 0,2-0,4 мкм) слегка изогнутые палочки, имеют вид запятой, очень полиморфны. На искусственных питательных средах, особенно в старых культурах, они могут иметь вид шаров, зерен, нитей, спиралей. Холерные вибрионы очень подвижны. Монотрихи - жгутик в несколько раз превышает длину клетки. Спор и капсул не образуют. Грамотрицательны. В окрашенных мазках располагаются в виде стаи рыб (см. рис. 51). При электронной микроскопии установлено, что между стенкой и цитоплазмой находятся вакуоли. Считают, что в этих вакуолях синтезируется экзотоксин.
Культивирование. Холерные вибрионы - факультативные анаэробы. К питательным средам неприхотливы. Щелочелюбивы. Размножаются при температуре 37-39° С и рН 8-9. Хорошо растут на МПА и МПБ. Элективной средой является щелочная 1% пептонная вода. На поверхности этой среды они образуют нежную голубоватую пленку. На плотной среде TBRS (тиосульфатцитратсахарозный агар с добавлением солей желчи) образуются колонии желтого цвета на фоне голубоватой среды. Размножаются быстро: в жидких питательных средах 6-8 ч, на плотных - 12-14 ч (на щелочных средах рост холерных вибрионов опережает рост других бактерий). Холерные вибрионы диссоциируют из S- в R-форму. Этот процесс сопровождается изменением антигенной структуры.
Ферментативные свойства. Холерные вибрионы биохимически активны. Они обладают сахаролитическими, протеолитическими и диастатическими свойствами. Сахаролитические свойства выражаются в расщеплении Сахаров до образования кислоты. Ферментация глюкозы, сахарозы, маннита, маннозы и отсутствие ферментации арабинозы являются важным диагностическим признаком. Протеолитические свойства: холерные вибрионы разжижают желатин, разлагают триптофан до образования индола, продуцируют оксидазу, восстанавливают нитраты в нитриты, свертывают молоко. Сероводород не образуют. Диастатические свойства выражаются в расщеплении растворимого крахмала.
Холерный вибрион продуцирует ферменты патогенности: фибринолизин, плазмокоагулазу, гиалуронидазу, лецитиназу, коллагеназу и др.
Токсинообразование. Холерные вибрионы продуцируют токсины трех типов. Токсин I типа - эндотоксин, выделяется при разрушении микробной клетки, термостабилен (липополисахарид). Считают, что он способствует развитию антибактериального иммунитета. Токсин И типа - экзотоксин (холероген) термолабилен, обладает энтеротоксическим действием и играет важную роль в патогенезе холеры (усиливает функцию секреторных клеток тонкого кишечника, что приводит к обезвоживанию организма). Токсин III типа термостабилен, считают, что он подавляет активный транспорт натрия через эпителий кишечника.
Антигенная структура. Холерные вибрионы имеют термостабильный соматический О-антиген и термолабильный Н-антиген. Н-антиген не специфический и является общим для всего рода Vibrio. О-антиген обладает видовой и типовой специфичностью. По О-антигену холерные вибрионы делят на 54 группы. Vibrio cholerae и Vibrio eltor относятся к О1 группе. Внутри О1 группы различают три компонента - А, В, С, по сочетанию которых выделяют три серовара. Сочетание АВ - серовар Огава, сочетание АС - серовар Инаба, сочетание ABC - серовар Гикокшима.
Устойчивость к факторам окружающей среды. При температуре 60° С холерные вибрионы погибают в течение 5 мин, при кипячении - мгновенно. Низкие температуры они переносят хорошо. Во льду сохраняются несколько месяцев, в морской и речной воде - несколько недель, в кишечнике мух - 4-5 дней. К высушиванию и солнечному свету холерные вибрионы очень чувствительны. Общепринятые концентрации дезинфицирующих веществ убивают их быстро. Однако при работе с возбудителем холеры пользуются дезинфицирующими растворами большей концентрации. Холерные вибрионы чувствительны к кислотам (хлороводородной кислоте и др.). Вибрион холеры Эль-Тор более устойчив.
Восприимчивость животных. В естественных условиях животные не болеют холерой. В экспериментальных условиях внутрибрюшинное введение холерных вибрионов кроликам и морским свинкам сопровождается выраженным токсикозом, который приводит их к гибели.
Источники инфекции и пути передачи. Единственным источником холеры является человек, который выделяет вибрион холеры во внешнюю среду в период заболевания либо носительства. При холере, вызванной вибрионом Эль-Тор, отмечается длительное носительство. Заражение человека происходит через продукты (овощи, фрукты), воду и другие объекты внешней среды.
Холера - это давно известная инфекция, которая периодически распространялась на многие страны и континенты и вызывала гибель миллионов людей. Известны несколько пандемий холеры. В 1917-1926 гг. было зарегистрировано 6 пандемий холеры. Эти пандемии вызывались классическим вибрионом Коха. В 60-х годах XX века начал распространяться возбудитель холеры вибрион Эль-Тор. В 70-х годах зарегистрированы случаи холеры, вызванные вибрионом Эль-Тор в некоторых городах Советского Союза.
Патогенез. Заражение происходит через рот. Попав в желудок, часть холерных бактерий гибнет в кислой среде желудка, а часть проникает в кишечник, где щелочная среда и обилие продуктов распада белков (в частности, пептон) способствуют их размножению.
На слизистой оболочке тонкой кишки накапливается большое количество холерных вибрионов и токсина, образующегося при их разрушении. Токсин нарушает функцию Слизистой оболочки, она гиперемируется, увеличивается проницаемость эпителия кишечника, нарушается секреторная и всасывающая функция его. Появляются профузные поносы, повторные рвоты, которые выводят из организма большое количество воды и солей (калия и натрия). Потеря большого количества жидкости и солей приводит к высушиванию ткани, сгущению крови, нарушению минерального обмена, поражению центральной и вегетативной нервных систем и других явлений интоксикации. От степени интоксикации зависит форма холеры, которая протекает в виде холерного энтерита, гастроэнтерита, альгидной и сухой формы (см. учебник инфекционных болезней).
Иммунитет. Стойкий, носит антимикробный и антитоксический характер, связанный с наличием агглютининов, вибриолизинов, антитоксинов и других антител. Кроме того, в иммунитете большое значение придают факторам местной защиты.
Профилактика. Проведение общих противоэпидемических мероприятий: раннее выявление больных, изоляция и госпитализация, дезинфекция, обсервация; охрана водоисточников, надзор за пищевыми продуктами, охрана границ при эпидемических вспышках и т. п. Для специфической профилактики используют убитую холерную вакцину (холероген-анатоксин в сочетании с О-антигеном холерного вибриона).
Лечение. Антибиотики тетрациклинового ряда, а также введение жидкости и электролитов (солей калия и натрия).
Контрольные вопросы
1. Какова морфологическая характеристика холерного вибриона? Какие Вы знаете биовары холерного вибриона?
2. Какая среда является элективной и средой накопления?
3. Каковы условия выращивания и культуральные свойства холерных вибрионов?
4. Каковы ферментативные свойства холерных вибрионов?
5. Какие токсины образуют холерные вибрионы?
Микробиологическое исследование
Холерные вибрионы очень чувствительны к дезинфицирующим веществам, поэтому в посуде, куда помещают исследуемый материал, не должно содержаться даже следов дезинфицирующих веществ. Время от взятия материала до проведения посевов не должно превышать 3 ч. Лучше материал сразу брать в 1% пептонную воду, являющуюся средой накопления (можно использовать другие среды накопления - щелочную консервированную жидкость с морской солью и др.).
Цель исследования: выявление холерного вибриона и определение его серовара.
1. Испражнения.
2. Рвотные массы.
3. Секционный материал.
Кроме того, обязательно исследуют воду, пищевые продукты и смывы с объектов внешней среды.

Способы сбора материала
При массовых обследованиях по эпидпоказаниям для выявления носительства можно делать групповые посевы. Материал от 4-5 обследуемых засевают в одну колбу с 100 мл 1% пептонной воды (исследование ведут как один анализ). При положительном ответе материал снова берут и засевают индивидуально.
При пересылке исследуемого материала банки с материалом плотно укладывают в металлическую посуду (бюкс, кастрюлю), прилагают сопроводительный документ с перечислением отправляемых материалов, указанием предполагаемого диагноза, времени и места взятия материала и фамилией собиравшего материал.
1. Бактериологический.
2. Микроскопический.
3. Серологический.
Исследование проводят поэтапно. Интервалы между этапами должны быть максимально короткими. Пересевы на жидкие среды проводят через 6-8 ч, а на плотные - через 12-18 ч (поэтапное исследование требует круглосуточной работы).

Этап I
Через 6-8 ч посевы на 1% пептонной воде вынимают из термостата. Пленку или материал с поверхности среды засевают на вторую пептонную воду и делают мазок, фиксируют, окрашивают карболовым фуксином и по Граму. Микроскопируют. Если в мазках обнаруживают сходные с холерным вибрионом подвижные бактерии, то ставят ориентировочную реакцию агглютинации с сывороткой. Для этого на обезжиренное предметное стекло наносят одну каплю О-сыворотки, разведенной в 100 раз. Контролем служит капля изотонического раствора натрия хлорида. В обе капли вносят материал из пленки и тщательно эмульгируют. При наличии в капле сыворотки агглютинации и отсутствии ее в контроле пленку засевают на щелочной агар и инкубируют в термостате.
Через 12-14 ч вынимают посевы из термостата. Изучают рост посевов на плотной питательной среде. При наличии подозрительных колоний отбирают не менее пяти и ставят реакцию агглютинации с О-сывороткой, разведенной 1:100, при наличии положительной реакции агглютинации можно поставить ориентировочную реакцию агглютинации с типовыми сыворотками Огава и Инаба (в разведении 1:50). Наличие положительной агглютинации при типичной морфологии и культуральных свойствах дает право дать предварительный положительный ответ.
Кроме этого материал из типичных колоний (давших положительную реакцию агглютинации) высевают на полиуглеводную среду (содержит 2-3 сахара) для выделения чистой культуры, а также в бульон.
Бульон инкубируют 3-4 ч при 37° С. С молодой бульонной культурой ставят развернутую реакцию агглютинации.
Через 12-14 ч вынимают посевы из термостата. На полиуглеводной среде изменяется цвет столбика (расщепление сахарозы). Скошенная часть не изменяется. Полученную культуру идентифицируют.
Идентификация культуры производится по следующим тестам.
1. Изучение морфологических свойств, подвижности висячей и раздавленной капле).
2. Изучение культуральных свойств.
3. Изучение антигенных свойств (в реакции агглютинации).
4. Изучение сахаролитических свойств.
5. Определение протеолитических свойств.
6. Определение гемолитических свойств.
7. Определение уреазной активности.
8. Изучение восстановительных свойств (реакция холера-рот).
9. Изучение диастатической активности.
10. Постановка реакции Фогеса - Проскауэра.
11. Проба на оксидазу.
12. Определение чувствительности к фагам.
13. Определение чувствительности к полимиксину.
Изучение морфологических свойств, подвижности и культуральных свойств проводят с первых этапов исследования.
Определение антигенных свойств. Ставят развернутую реакцию агглютинации с видоспецифической холерной О-сывороткой и типоспецифическими сыворотками Огава и Инаба.
Реакцию ставят в объеме 1 мл. Сыворотки разводят начиная с 1:50 до титра. К каждому разведению добавляют по 2 капли выделенной культуры, реакцию сопровождают контролем сыворотки и контролем культуры. Учитывают реакцию через 18-20 ч. Положительная реакция должна быть не менее половины титра сыворотки.
Ферментацию углеводов определяют на средах Гисса. Результаты учитывают через 6-14 ч. Расщепление глюкозы, сахарозы, маннита, мальтозы и манозы при отсутствии ферментации арабинозы является диагностическим показателем.
Протеолитические свойства определяют путем посева выделенной культуры в столбик желатина; инкубируют при 22° С 2-3 дня. Положительная реакция выражается в воронкообразном разжижении желатина.
Гемолитические свойства определяют путем добавления к 1 мл 24-часовой бульонной культуры 1 мл 1% взвеси эритроцитов барана. Контролем служит 1 мл бульона + 1 мл 1% взвеси эритроцитов. Обе пробирки инкубируют 2 ч при 37° С. Затем переносят на холод.
Учет производят через 16 ч. При положительном результате в опытной пробирке (V. eltor) эритроциты гемолизируются (лаковая кровь), в контрольной - неизмененная взвесь эритроцитов. V. cholerae гемолиза не вызывает.
Уреазную активность определяют посевом выделенной культуры на среду с мочевиной. Положительный результат характеризуется изменением желтого цвета среды в красный.
Изучение восстановительных свойств (реакция холера-рот). Холерные вибрионы восстанавливают нитраты в нитриты. При добавлении к 24-часовой культуре концентрированной серной кислоты из расчета 2-3 капли на 1 мл культуры освобождается азотистая кислота, которая, связываясь к индолом, образует новое соединение (нитрозоиндол). Среда окрашивается в рубиново-красный цвет.
Диастатическую активность определяют на среде Кодама, содержащей растворимый крахмал. Индикатором служит раствор Люголя. Холерные вибрионы расщепляют крахмал, поэтому цвет среды после прибавления раствора Люголя не изменяется.
Реакция Фогеса - Проскауэра. Исследуемую культуру засевают в среду Кларка. Посев ставят в термостат. После 2-3 дней инкубации посевы вынимают из термостата и к 1 мл выросшей культуры добавляют 0,6 мл α-нафтола и 0,2 мл 40% раствора гидроксида натрия. Положительная реакция характеризуется появлением красного окрашивания (за счет ацетилметилкарбинола).
Проба на оксидазу. На поверхность 18-часовой агаровой культуры наносят каплю 1% водного раствора параамино-диметиланилина (гидрохлорида или оксалата), добавляют каплю 1% спиртового раствора α-нафтола. При положительной реакции на оксидазу через 2-3 мин культура окрашивается в ярко-синий цвет.
Определение чувствительности к фагам. Исследуемую культуру засевают на щелочной агар и наносят бактериофаг С Мукерджи IV типа и бактериофаг Эль-Тор. Реакцию учитывают через 14-16 ч (см. главу 8; табл. 40).
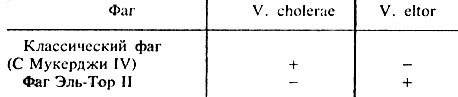
Таблица 40. Чувствительность к холерным фагам
Примечание. + лизируется; - не лизируется.
Определение чувствительности к полимиксину. В расплавленный и остуженный агар добавляют полимиксин (из расчета 50 ед. в 1 мл среды). Среду размешивают и разливают в чашки Петри. На застывшую среду петлей засевают выделенную культуру и инкубируют в термостате. Через 8-10 ч вынимают посевы из термостата. Холерные вибрионы не растут в присутствии полимиксина. Вибрионы Эль-Тор вырастают (табл. 41).

Таблица 41. Дифференциальные свойства V. cholerae, V. eltor и нехолерных вибрионов
Реакция иммобилизации. На предметное стекло наносят 2 капли испражнений или материала с поверхности пептонной воды. К 1-й капле добавляют одну каплю О-сыворотки (1:100), ко 2-й - каплю изотонического раствора натрия хлорида. Каждую каплю эмульгируют пастеровской пипеткой или петлей, накрывают покровным стеклом и просматривают под микроскопом. При положительном результате в первой капле прекращается движение вибрионов (действие специфической сыворотки), во второй наблюдается движение.
Люминесцентно-серологический метод. См. главу 2.
1. Каковы основные методы идентификации холерных вибрионов?
2. Результаты каких исследований дают право дать предварительный ответ?
3. Какие методы служат для дифференциации классического холерного вибриона от вибриона Эль-Тор?
4. На чем основан ускоренный метод иммобилизации холерных вибрионов?
1% пептонная вода. На 1 л дистиллированной воды берут 10 г пептона, 5 г хлорида натрия, 0,1 г нитрата калия и карбоната натрия до установления рН 9,0. Полученную среду разливают во флаконы и пробирки. Стерилизуют в автоклаве 20 мин при 120° С.
Щелочной агар. К 1л МП А добавляют 30 мл 10% раствора карбоната натрия, кипятят 45 мин, устанавливают рН 8,0-9,0. Разливают во флаконы и пробирки. Стерилизуют в автоклаве 20 мин при 120° С.
Среда Кларка. 5 г двузамещенного фосфата калия, 5 г пептона, 5 г глюкозы растворяют в 1 л дистиллированной воды. Среду доводят до кипения, фильтруют, разливают в пробирки. Стерилизуют при 0,5 атм в течение 30 мин.
Среда ТСВ. Сухая среда (рН 8,6) выпускается фирмой Дифко (США).
Когда вы шукаете возможность оттянуться трахом с симпатичной шлюхой из вашего района, то жаждим вам взыскивать красивых проституток беспрепятственно на этом веб-ресурсе prostitutkichelyabinskahot.com
|
ПОИСК:
|
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'