
Глава 26. Возбудитель чумы
Бактерии чумы открыты были Иерсеном в Гонконге в 1894 г. и в честь него весь род был назван иерсиниями. Большой вклад в изучение чумы внесли русские ученые Д. К. Заболотный, Н. К. Клодницкий, И. А. Лебединский, Н. Ф. Гамалея и индийские ученые, предложившие для лечения чумы стрептомицин.
К роду иерсиний относятся три вида бактерий:
1. Yersiniae pestis - возбудители чумы.
2. Yersiniae pseudotuberculosis - возбудители псевдотуберкулеза.
3. Yersiniae enterocolitica - возбудители кишечных инфекций.
Все представители этого рода грамотрицательные палочки, имеющие чаще овоидную форму и величину 0,4-0,7 × 1-2 мкм. Спор не образуют. У возбудителей псевдотуберкулеза и иерсиний энтероколитика имеются жгутики. Все иерсиний неприхотливы к питательным средам. Ферментативно они активны: расщепляют ряд углеводов с образованием кислоты.
Морфология. Возбудитель чумы - бвоидная палочка, средний размер 0,3-0,6 × 1-2 мкм. Они очень полиморфны. В мазках с плотной питательной среды палочки бывают удлиненными, нитевидными, описаны также фильтрующиеся формы. Бактерии чумы не имеют спор, жгутиков, образуют нежную капсулу. Грамотрицательны. Ввиду неравномерного распределения цитоплазмы концы палочек окрашиваются интенсивнее. Такая биполярность хорошо видна при окраске их метиленовым синим (рис. 46).
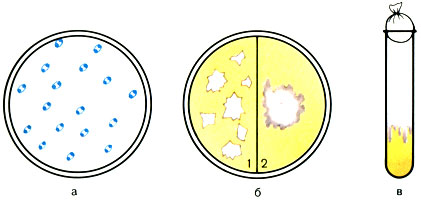
Рис. 46. Морфологические и культуральные свойства возбудителя чумы (Jersinia pestis). а - бактерии чумы (окраска синим Леффлера); б - рост на МПА: 1 - через 24 ч в виде битого стекла; 2 - через 48 ч в виде кружевного платочка; в - рост на МПБ - 'сталактитовый'
Культивирование. Возбудители чумы - факультативные анаэробы. Не прихотливы, растут на обычных питательных средах при температуре 28-30° С, рН среды 7,0-7,2. Рост появляется через 12-14 ч. Для ускорения роста применяют стимуляторы (экстракты некоторых бактерий, например сарцин, свежегемолизированную кровь, сульфит натрия и др.). Элективными средами для выращивания возбудителей чумы являются казеиновые среды и гидролизаты кровяных сгустков. Выросшие колонии через 18-24 ч инкубации имеют вид мелких глыбок с неровными краями, через 48 ч края колоний приобретают фестончатый вид и напоминают "кружевной платочек" (см. рис. 46).
На скошенном агаре культура растет в виде вязкого налета; на НПБ - в виде рыхлых хлопьев, взвешенных в прозрачной жидкости. При более длительном росте с поверхности среды спускаются рыхлые нити: "сталактитовый рост". Бактерии чумы растут в R-форме, которая является вирулентной. Однако они легко диссоциируют под влиянием ряда факторов, например бактериофага и через О-форму переходят в S-авирулентную форму.
Ферментативные свойства. У чумных бактерий выражена сахаролитическая активность - они расщепляют сахарозу, мальтозу, арабинозу, рамнозу, глюкозу (не всегда) и маннит с образованием кислоты. Различают два варианта бактерий чумы - разлагающие и не разлагающие глицерин. Протеолитические свойства выражены слабо: они не разжижают желатин, не свертывают молоко, образуют сероводород.
Бактерии чумы продуцируют фибринолизин, гемолизин, гиалуронидазу, коагулазу.
Токсинообразование. Токсин чумной палочки представляет собой особый белок, сочетающий свойства экзо- и эндотоксина, он состоит из двух белковых фракций (А и В), различающихся по аминокислотному составу и антигенным свойствам. Он очень токсичен для человека. Чумный токсин называют мышиный яд, так как мыши высоко чувствительны к его действию.
Антигенная структура бактерий чумы сложна. Микробы чумы содержат около десяти различных антигенов: фракции F, V, W и др. Фракция F - основной компонент, связанный с капсулой; V и W компоненты препятствуют фагоцитированию клетки. У бактерий чумы имеются общие антигены с возбудителем псевдотуберкулеза, эшерихиями, шигеллами и эритроцитами человека О-группы.
Устойчивость к факторам окружающей среды. Высокие температуры (100° С) губят чумные бактерии мгновенно, 80° С - через 5 мин. Низкие температуры чумные бактерии переносят хорошо: при 0° С сохраняются 6 мес, в замороженных трупах - год и больше. Прямые солнечные лучи убивают их через 2-3 ч. Чумные бактерии очень чувствительны к высыханию. В пищевых продуктах они сохраняются от 2 до 6 мес. В блохах - до года.
Обычные концентрации дезинфицирующих растворов убивают их через 5-10 мин. Особенно они чувствительны к сулеме и карболовой кислоте.
Восприимчивость животных. Основными носителями чумы являются грызуны: сурки, суслики, тарабаганы; они обусловливают природную очаговость чумы. Очень чувствительны к чуме серые и черные крысы, мыши; восприимчивы также верблюды, лисицы, кошки. К экспериментальному заражению чувствительны мыши, крысы, морские свинки и др.
Источники заражения. Больные животные, в основном грызуны. Эпидемии у людей часто предшествуют эпизоотии у грызунов.
Пути передачи и переносчики. 1. Основной путь передачи - трансмиссивный. Переносчики - блохи (грызуны → блохи → человек).
2. Воздушно-капельный путь (заражение человека от человека при легочной форме чумы).
3. Пищевой - при употреблении в пищу плохо проваренного зараженного мяса (этот путь бывает редко).
Патогенез и формы заболевания. Входными воротами являются кожа и слизистые оболочки дыхательных путей и пищеварительного тракта. Возбудители чумы обладают большой инвазивной способностью. На месте проникновения возбудителя образуются папулы, переходящие в пустулу с кровянисто-гнойным содержимым. В патологический процесс вовлекаются регионарные лимфатические узлы, через которые микробы проникают в кровь, вызывая бактерифмию. С кровью они попадают во внутренние органы.
В зависимости от места локализации у человека могут возникнуть разные формы заболевания: кожная, кожно-бубонная, кишечная, легочная, первично-септическая; каждая форма может закончиться сепсисом (вторичная септицемия). Наиболее часто возникает бубонная форма. Бубон болезнен. При попадании большой дозы возбудителя и малой разистентности организма может возникнуть первично-септическая форма. Заболевание начинается остро и протекает с явлениями интоксикации - высокой температурой, головной болью и т. д.
Иммунитет. Напряженный и продолжительный (в прошлые века в период больших эпидемий переболевших использовали для ухода за больными). Иммунитет обусловливается системой макрофагов. Большое значение имеет фагоцитарный фактор.
Профилактика. Общие мероприятия заключаются в ранней диагностике, изоляции больных. Установление карантина для людей, находившихся в контакте с больными. Проведение в очагах дезинсекции и дератизации. Защита медицинского персонала, находящегося в очагах, проводится введением стрептомицина и противочумной вакцины. Выполнение международных конвенций по профилактике чумы (дератизация и дезинфекция кораблей в портах). Охрана государственных границ.
Специфическая профилактика. В СССР применяют живую вакцину EV. Этот штамм был получен из вирулентной культуры путем последовательных пересевов возбудителя на питательные среды в течение 5 лет. Штамм потерял вирулентность, сохранив при этом иммуногенные свойства. Иммунитет длится около года. Вакцинируют только людей, которым угрожает опасность заражения.
Лечение. Стрептомицин, тетрациклин, специфический фаг и противочумный иммуноглобулин.
Большой вклад в изучение профилактики и лечения чумы внесли советские ученые М. П. Покровская и Н. Н. Жуков-Вережников.
Контрольные вопросы
1. К какой группе инфекций относится чума?
2. Как растет возбудитель чумы на плотных и жидких питательных средах? Какая форма является вирулентной - R или S?
3. Какой токсин образует возбудитель чумы и какие Вы знаете ферменты патогенности?
4. Кто является источником и переносчиком чумы?
5. Какие формы заболевания вызывает палочка чумы?
Микробиологическое исследование
Цель исследования: выявление возбудителя чумы.
Материал для исследования
1. Отделяемое язвы или пунктат из карбункула - кожная форма.
2. Содержимое бубона - бубонная форма.
3. Мокрота - легочная форма.
4. Испражнения - кишечная форма.
5. Кровь - при всех формах.
6. На вскрытии берут кусочки органов трупа, кровь, костный мозг.
7. Блохи - содержимое кишечника.
8. Крысы, мыши и другие погибшие грызуны (и болеющие) - вскрывают, исследуют органы и кровь.
Способы сбора материала

Способы сбора материала
Основные методы исследования
1. Микроскопический.
2. Бактериологический.
3. Биологический.
4. Люминесцентно-серологический метод (см. главу 2).
Методы серодиагностики не нашли широкого применения.
Ход исследования
Первый день исследования

Первый день исследования
Посев. Незагрязненный посторонней флорой материал засевают на плотные и жидкие питательные среды (МПА и МПБ) с прибавлением к ним стимуляторов: кровь, сульфит натрия и др. Стимуляция роста необходима, так как посевная доза может быть недостаточной. Материал, содержащий постороннюю флору (мокрота, содержимое открытых язв), засевают на среду Туманского или среду Коробковой. Эти среды содержат генциановый фиолетовый (1:50000), подавляющий рост посторонней флоры. Посевы инкубируют в термостате при 28° С.
Биологическая проба. Биопробу ставят на морских свинках и белых мышах. Метод введения исследуемого материала зависит от характера материала. Мокроту, гной из открытого абсцесса вводят путем втирания в кожу брюшной стенки (предварительно кожу эпилируют, обрабатывают стерильным изотоническим раствором натрия хлорида и скарифицируют). На скарифицированный участок наносят исследуемый материал, втирая его плоской частью скальпеля, под прикрытием специальной воронки или стеклянной крышки от чашки Петри. Незагрязненный материал (кровь, содержимое закрытого бубона) вводят животным подкожно или внутрибрюшинно. В зависимости от метода введения животное погибает на 3-9-й день.
Второй день исследования
Посевы вынимают из термостата. Изучают рост на плотной и жидкой питательной среде.
Из бульонной культуры при типичном росте делают мазки, окрашивают по Граму и метиленовым синим. Микроскопируют. Из плотной питательной среды при наличии типичных колоний выделяют чистую культуру и помещают в термостат. На 2-3 подозрительные в отношении возбудителя чумы колонии наносят чумный бактериофаг. Инкубируют в термостате. Через 10-12 ч колонии изменяются - лизируются. Лизис колоний под действием чумного бактериофага имеет диагностическое значение.
Третий день исследования
Вынимают из термостата пробирки с культурой на скошенном агаре. На поверхности агара чумная палочка образует вязкий серовато-белый налет. Выделенную культуру проверяют микроскопически. При наличии типичных палочек проверяют сахаролитические свойства посевом на сахара: глюкозу, мальтозу, сахарозу, рамнозу, маннит. Ставят пробу с бактериофагом.
Четвертый день исследования
Производят учет результатов: 1. Ферментативные свойства (табл. 42).
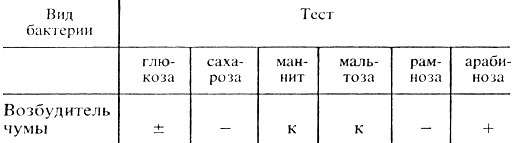
Таблица 42. Ферментативные свойства возбудителей чумы
Примечание. к - кислота; - отсутствие расщепления; ± не всегда расщепляет; + расщепление.
Проба с бактериофагом - лизис колоний.
Ускоренный метод пробы с бактериофагом. Исследуемый материал наносят на 3 чашки со средой Туманского.
1-я чашка - засевают вместе с чумным бактериофагом.
2-я чашка - засевают равномерным распределением материала по поверхности среды (шпателем), после чего делают дорожку из чумного бактериофага.
3-я чашка (контрольная) - засевают только исследуемым материалом. Посевы инкубируют при 28° С. Через 12-14 ч чашки вынимают из термостата.
При наличии в исследуемом материале возбудителя чумы отмечают:
в 1-й чашке - негативные колонии (лизис колоний чумы), во 2-й чашке - стерильную дорожку, в 3-й чашке - типичные колонии чумных бактерий.
Проводят дифференциацию чумных бактерий от бактерий псевдотуберкулеза (табл. 43).
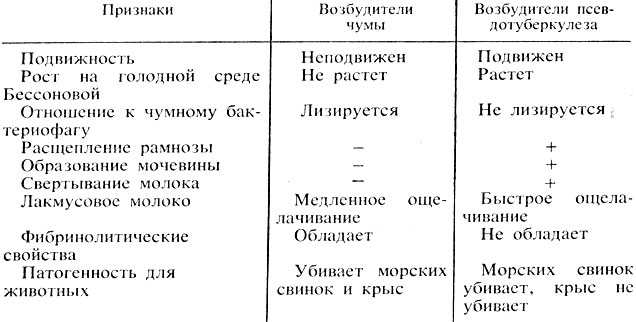
Таблица 43. Дифференциация возбудителей чумы и бактерий псевдотуберкулеза
Продолжают наблюдение за животными, зараженными в первый день исследования. Павших или убитых животных вскрывают. Изучают изменения в органах. Обычно у животных, павших от чумы, увеличены регионарные узлы, в органах - геморрагические и некротические участки. Печень и селезенка увеличены. При вскрытии из органов и крови делают мазки-отпечатки на специальные среды. Дальнейшее исследование ведут описанным выше способом.
Контрольные вопросы
1. Какой режим работы необходимо соблюдать при работе с возбудителями чумы?
2. Какие методы являются ведущими? В каких случаях следует прибавить в среду генциановый фиолетовый?
3. На каких животных ставят биопробу? Какие изменения обнаруживают у павших животных?
4. Как дифференцируют возбудителей чумы от бактерий псевдотуберкулеза?
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'