
Другие обезболивающие средства - морфин и родственные соединения
Органической молекулой, веками занимающей главенствующее место в арсенале средств, используемых врачами для облегчения жестоких болей, является морфин. Морфин - основной действующий компонент опия и как таковой использовался еще в те времена, к которым относятся первые дошедшие до нас письменные источники. По обезболивающему действию морфин в 50 раз превосходит аспирин. Основными недостатками морфина являются возникновение болезненного пристрастия к нему и угнетение дыхания.
Несмотря на то что морфин в течение столь долгого времени был незаменим в медицинской практике, в чистом виде он был выделен из опия только в 1803 г. Затем прошло еще более 100 лет, прежде чем в 1925 г. была предложена, хотя и не полностью установлена, правильная структура этой сложной молекулы. Часть этой победы принадлежит Джону Гуланду и Роберту Робинсону, работавшим в Англии.
Молекула морфина на первый взгляд в целом кажется очень сложной, однако, если рассматривать ее как производное фенантрена, она оказывается довольно простой. Скелет морфина отличается от скелета фенантрена в основном наличием мостика -N-C-C- между атомами 9 и 13.
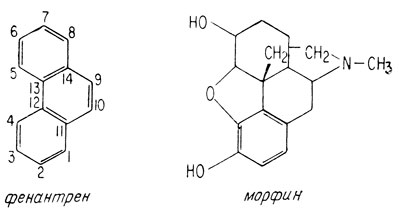
В структуре, предложенной Гуландом и Робинсоном, не было точно установлено место присоединения углеродного конца этого мостика; в настоящее время известно, что он присоединен к 13-му атому.
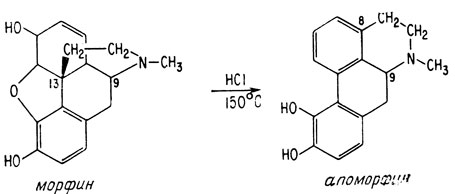
Впервые мысль о наличии в молекуле морфина углеродного скелета молекулы фенантрена возникла в 1881 г., когда при перегонке морфина над цинковой пылью был выделен фенантрен. В результате осуществления ряда других реакций, связанных с разрушением молекулы морфина, было установлено положение атомов кислорода. В 1949 г. Рудольф Грев в Германии синтезировал производное фенантрена, у которого мостик -N-C-C- соединял положения 9 и 13. Оказалось, что это производное идентично продукту, образующемуся при разложении морфина, что явилось веским подтверждением предположения о том, что в морфине углеродный конец мостика присоединен в положение 13. Одной из причин, почему вопрос о положении мостика оказался столь сложным, было то, что в горячей соляной кислоте молекула морфина разлагается и перегруппировывается со смещением углеродного конца мостика, образуя апоморфин. Вначале не подозревали о наличии перегруппировки и считали, что морфин имеет такой же азотуглеродный скелет, как и апоморфин.
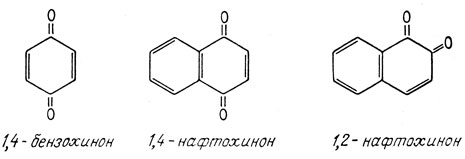
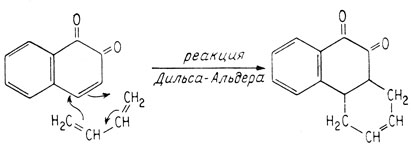
Полный синтез морфина, осуществленный Маршаллом Гэйтсом в 1952 г., довершил установление его структуры. По традиции, предполагаемая структура не считается "доказанной" до тех пор, пока она не будет синтезирована из простых молекул, обладающих надежно установленными структурами, и пока не удастся показать, что продукт такого синтеза идентичен веществу, о котором идет речь. Ключевой стадией синтеза морфина явилось присоединение бутадиена к соответствующему производному 1,2-нафтохи-нона. Реакция присоединения такого типа называется реакцией Дильса-Альдера; она получила свое название по имени открывших ее ученых. Эта реакция широко используется для синтеза молекул, содержащих шестичленные кольца, которые встречаются во многих природных продуктах. Она состоит в присоединении диена к олефину. Обычно олефин активируют, вводя по соседству с двойной углерод-углеродной связью карбонильную группу, как, например, в хиноне.
При присоединении диена к двойной связи 1,2-нафтохинона образуется углеродный скелет фенантрена, обнаруживаемый в морфине.
Для синтеза морфина было специально получено производное нафтохинона, содержащее в соответствующем положении цианометильную группу (-CH2-C=N), которая затем в результате ряда реакций была превращена в C-C-N-мостик морфина.
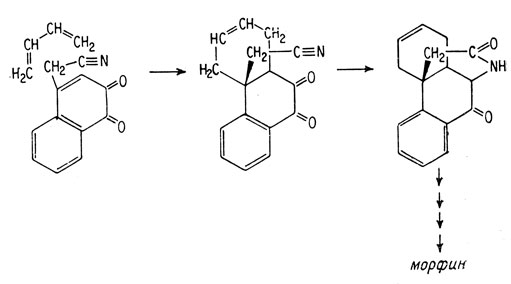
Синтез морфина в лаборатории - медленный и трудоемкий процесс. Тем не менее молекула морфина была и остается в центре внимания огромного числа лабораторных исследований. Основная цель этих работ - попытаться так модифицировать структуру молекулы, чтобы устранить нежелательные свойства морфина, такие, как болезненное пристрастие к нему и угнетение дыхания, не снижая в то же время его способности оказывать обезболивающее действие. Хотя такая цель еще полностью не достигнута, однако эти исследования дали интересные сведения и позволили получить новые полезные лекарственные препараты, частично получаемые синтетическим путем. Кроме того, подобное исследование позволяет установить связь между структурой молекулы и оказываемым ею физиологическим действием.
Хорошо известны два простых производных морфина - кодеин и героин: кодеин представляет собой метилморфин, а героин - диацетилморфин.
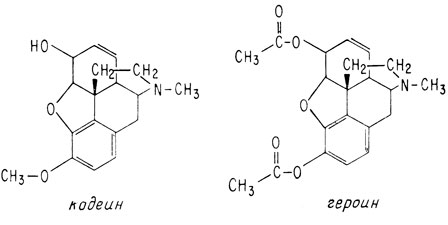
Кодеин, как и морфин, присутствует в опии, но в столь малых количествах, что обычно его получают метилированием более распространенного морфина. Кодеин в меньшей степени вызывает развитие стойкой привычки к нему и применяется как местное анестезирующее средство, а также как наркотик в составе лекарств от кашля.
Героин в природе не встречается, и его получают, ацетилируя морфин, так же, как синтезируют аспирин, ацетилируя салициловую кислоту. Героин настолько опасен с точки зрения развития болезненного пристрастия к нему, что в США его производство и импорт запрещены законом.
Замечательным примером вещества, обладающего очень сильным наркотическим действием, может служить полученная недавно структурная модификация морфина. Это соединение, синтезированное английским химиком К. Бентли, обладает в 10000 раз более сильным действием, чем морфин. Один миллиграмм этого вещества способен сделать послушным дикого слона.
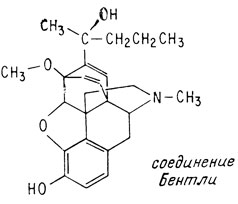
Однако надежды на то, что незначительные количества этого вещества могут быть использованы для человека как обезболивающее средство, которое при том не угнетало бы дыхания, не оправдались. Получены также доказательства того, что при употреблении этого вещества развивается болезненное пристрастие к нему. В течение долгого времени все попытки избавиться от нежелательных побочных свойств оказывались тщетными. По-видимому, лишь вещества, обладающие слабым обезболивающим действием, свободны от возникновения пристрастия к ним.
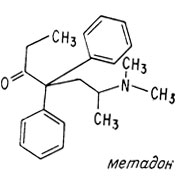
Структурным аналогом морфина, нашедшим широкое применение как менее опасный (с точки зрения развития пристрастия к нему), является метадон. Однако и метадон относят к наркотикам, способным приводить к наркомании.
Достигнутые в последнее время успехи по крайней мере в частичном отделении "добра от зла" у молекул, аналогичных морфину, связаны с открытием, сделанным более 50 лет назад, значение которого не было оценено по заслугам в течение десятилетий. Юлиус Пол, химик из университета Бреслау, в молекуле кодеина удалил метильную группу, присоединенную к атому азота, и заменил ее аллильной группой (-CH2-CH=CH2). Получившаяся в результате такой замены молекула названа N-аллилноркодеином (приставка нор- указывает, что атом углерода удален из молекулы). Введение этого аллильного производного животному, которому до этого дали морфин, противодействовало угнетению дыхания.
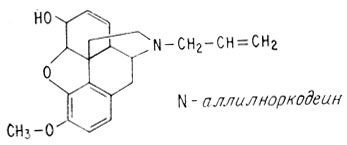
Однако на этот факт не обращали внимание вплоть до 1942 г., когда то же самое было проделано с морфином и был получен N-аллилнорморфин, известный под названием налорфина
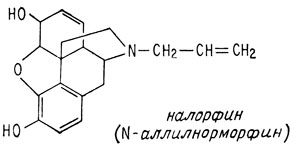
Оказалось, что налорфин противодействует угнетению дыхания, а также острому отравлению - эффектам, вызываемым приемом морфина. При введении этого препарата наркоману быстро проявляются симптомы выведения наркотика из организма. К сожалению, испытания, проведенные на животных, показали, что налорфин не обладает обезболивающим действием.
Затем в 1954 г. в Главном Массачусетском госпитале Генри Бичер и Луи Ласанья попытались выяснить, может ли налорфин уменьшить вызываемое морфином угнетение дыхания, не снижая эффекта обезболивания. Они давали одной группе больных морфин и налорфин, а другой группе для сравнения - только налорфин. К удивлению, в отличие от результатов, полученных ранее в опытах на животных, налорфин сам по себе оказывал такое же обезболивающее действие, как и в сочетании с морфином. Наградой исследователям было то, что, как показали дальнейшие испытания, применение налорфина не вызывает возникновения пристрастия к нему. Это был первый пример мощного обезболивающего средства, к которому у человека не развивается пристрастия. До этого лишь слабые обезболивающие вещества не создавали угрозы возникновения привычки к их употреблению. Однако радость была недолговечной, поскольку дальнейшие исследования показали, что клинические дозы налорфина вызывают галлюцинации.
Одним из наиболее эффективных веществ, полученных в результате превращений морфина, является пентазоцин, синтезированный в институте Стерлинг-Винтропа.
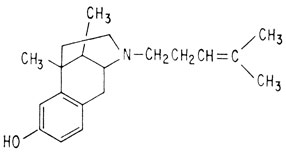
Пентазоцин
Он по эффективности не уступает морфину, облегчая послеоперационные боли, боли при родах, боли в сердце и др. Как показала современная практика, он не вызывает развития болезненного пристрастия к нему. Однако этот препарат нельзя квалифицировать как идеальное обезболивающее средство, поскольку он угнетает дыхание. Таким образом, поиски продолжаются и будут продолжаться до тех пор, пока не будет получено идеальное средство.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'