
Механизм действия ферментов, установленный на основании использования структур кристаллов
Лизоцим был третьим по счету белком и первым ферментом, структура которого была установлена методом рентгеноструктурного анализа при высоком разрешении. В настоящее время аналогичным образом охарактеризованы структуры многих других ферментов, в том числе рибонуклеазы, карбоксипептидазы, папаина, химотрипсина и субтилизина. Лизоцим, однако, по-прежнему остается самым ярким примером применения рентгенографии для объяснения характера действия ферментов.
Мукополисахариды, из которых состоят клеточные стенки бактерий, расщепляются под действием лизоцима. Филлипс и его сотрудники сумели ввести некоторые аналоги природного субстрата в кристаллы белка. Эти соединения представляют собой низкомолекулярные соединения (олигомеры), состоящие из таких же звеньев, которые находятся в высокомолекулярном (полимерном) природном субстрате, образованном чередованием N-ацетилглюкозамина (НАГ) и N-ацетилмурамовой кислоты (НАМ)
Оказалось, что димеры и тримеры НАГ образуют с лизоцимом стабильные изоморфные комплексы. Были рассчитаны карты различия электронных плотностей (фурье-представления) природных белков и комплекса белок - ингибитор. Олигомеры НАГ более высокого молекулярного веса представляют собой субстраты, и потому их нельзя использовать для расчета рентгенограмм. Природный субстрат имеет слишком большую молекулу, которую невозможно ввести в кристалл лизоцима. При изучении упомянутых выше комплексов белок - ингибитор были установлены центры, в которых происходит связывание субстрата и ингибиторов, имеющих строение, близкое к субстрату.
Ранее была рассмотрена структура, предложенная для лизоцима на основании проведения анализа при высоком разрешении (рис. 10.11). Ясно видна впадина, образуемая субстратом (рис. 10.25). Дифференциальный синтез Фурье ясно показывает, что ингибиторы [особенно тример (НАГ)3] присоединены к одному концу этой впадины (рис. 10.25).
![Рис. 10.25. Пространственные модели лизоцима с субстратом, заполняющим углубление, содержащее активный центр, и без него [1]](pic/000426.jpg)
Рис. 10.25. Пространственные модели лизоцима с субстратом, заполняющим углубление, содержащее активный центр, и без него [1]
Пространственная модель, построенная на основании комплексов белок - ингибитор, приводит к представлению о связывании субстратов с активным центром фермента. Следует напомнить, что большинство неполярных или гидрофобных аминокислотных остатков находятся внутри молекулы, удерживаясь в этом положении специфическими внутримолекулярными водородными связями, включающими специфическое взаимодействие боковых цепей. Большая часть гидрофобных боковых цепей, находящихся на поверхности белковой молекулы, выстилает это углубление. Таким образом, углубление представляется вероятным местом нахождения активного центра.
Вероятный механизм действия ферментов был предложен Филлипсом [8] на основании рассмотрения возможных взаимодействий субстрата с боковыми цепями, находящимися внутри углубления. Он предположил, что глутаминовая кислота (Gly 35) притягивает гликозидный кислород, связывающий НАГ и НАМ, ослабляя и затем разрывая связь С-О. Это приводит к образованию промежуточного иона карбоксония. Отрицательно заряженная боковая цепь аспарагиновой кислоты (Asp 52) способствует стабилизации образующегося промежуточного иона. Реакция завершается вовлечением молекулы воды, которая отдает протон Gly 35, а гидроксил - промежуточному карбониевому иону. Схематически этот процесс изображен на рис. 10.26.
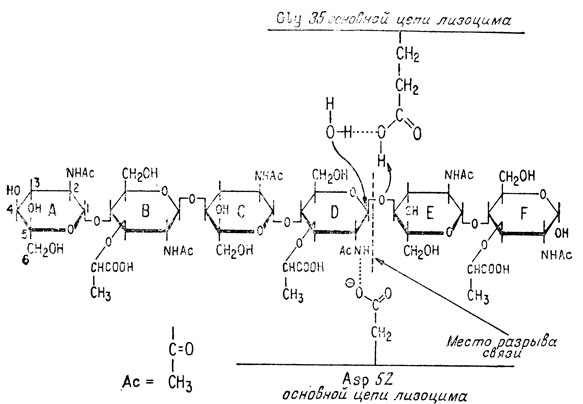
Рис. 10.26. Схематическое изображение механизма расщепления полисахаридного субстрата под действием лизоцима. Полисахарид состоит из чередующихся остатков N-ацетилглюкозамина (НАГ) и N-ацетилмурамовой кислоты (НАМ). На данной схеме изображено расщепление, происходящее между НАМ (D-кольцо) и НАГ (Е-кольцо). В то время как остаток аспарагиновой кислоты, находящийся в положении 52 лизоцима, взаимодействует с амидом и возникающий ион карбония стабилизуется, остаток глутаминовой кислоты, находящийся в положении 35 цепи лизоцима, может протонировать гликозидную связь между кольцами D и Е. Это делает возможной нуклеофильную атаку положения 1 D-кольца молекулой воды, что приводит к разрыву цепи
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'