
Б. Орбитали
Представления о структуре атома коренным образом изменились в течение первых двух десятилетий XX столетия в результате работ трех ученых - Нильса Бора, Вернера Гейзенберга и Эрвина Шредингера. Нильс Бор, работавший в Дании, ввел представление о том, что электроны вокруг ядра вращаются по круговым орбитам. Его теория хорошо объясняла строение водорода, однако встречалась с серьезными затруднениями в случае других атомов, поскольку электрон не движется по орбите, подобно твердому шарику. Вернер Гейзенберг в Германии высказал предположение о волновой природе движения электронов. Точного положения электронов определить нельзя, поскольку для такого определения положения электрона во времени и пространстве потребовались бы воздействия, которые приводили бы к возбуждению электрона и тем самым изменяли его положение. Это ограничение точности определения местоположения любого объекта известно как принцип неопределенности Гейзенберга. Эрвин Шредингер, также работавший в Германии, сформулировал волновые уравнения, описывающие движение электронов вокруг ядер. Этим устранялись жесткие ограничения, существовавшие для строго определенных круговых орбит Бора. Принималось, что электроны распределены по орбиталям или группам орбиталей. Строго говоря, термин "орбиталь" является математическим представлением для описания движения электрона три вращении вокруг ядра. Для наглядности мы считаем, что орбитали определяют наиболее вероятное местонахождение электронов. Орбитали группируются в оболочки и подоболочки, отличающиеся друг от друга по характеру движения (квантовым числам) электронов при их движении вокруг ядра.
Движение электронов вокруг ядра можно охарактеризовать при помощи нескольких квантовых чисел. Главное квантовое число n приближенно характеризует размер электронного облака или энергетический уровень орбитали, по которой движется электрон. Главное квантовое число может принимать целочисленные значения 1, 2, 3, 4, ..., но не может быть равным нулю. Эти энергетические уровни обозначают буквами K, L, M, N, ... в порядке возрастания энергии. Орбитальное квантовое число l описывает форму электронного облака (сферическое, имеющее форму гантели и т. д.). Оно может принимать значения 0, 1, 2, 3 ... (n-1). Магнитное квантовое число m описывает ориентацию электронного облака в пространстве. Оно принимает значения целых чисел от +l до -l. Наконец, спиновое квантовое число s показывает направление спина электрона. Оно может принимать значения +1/2 или - 1/2.
Электроны с одинаковым значением n принадлежат к одной и той же электронной оболочке. Электроны с одинаковыми значениями п и l относятся к одной подоболочке, а электроны с одинаковыми значениями n, l и m находятся на одной орбитали.
Из табл. 1 можно видеть взаимосвязь разных квантовых чисел. На рис. 1 представлено распределение электронной плотности для различных электронов. Электронная плотность s-орбиталей имеет сферическую симметрию относительно начала координат (рис. 1, а). На рис. 1,6 показано электронное облако s-электрона и зависимость его электронной плотности от расстояния от ядра. На рис. 1,в приведено пространственное изображение трех p-орбиталей, пересекающихся в точке начала координат, но равномерно распределенных по осям x, y и z. Поскольку электроны, располагающиеся на одной орбитали (т. е. имеющие одинаковые значения n, l и m), могут обладать спином, равным либо +1/2, либо -1/2, на каждой орбитали может находиться только два электрона с противоположными спинами. Такие электроны называются спаренными. Принцип, вводящий эти ограничения электронной структуры, известен как принцип Паули и назван так по имени ученого, впервые его предложившего. Гунд сформулировал правило, согласно которому орбитали, обладающие одинаковой энергией, например 2px, 2py, 2pz, должны сначала заполняться одним электроном, а затем уже может происходить спаривание электронов. В табл. 2 приведено электронное распределение для атомов первых трех периодов периодической системы элементов. Из данных этой таблицы следует, что выполняется как принцип Паули, так и правило Гунда.
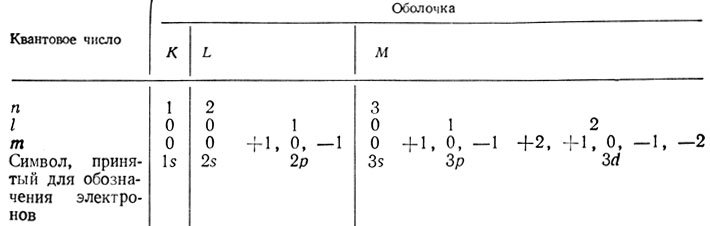
Таблица 1. Взаимосвязь квантовых чисел
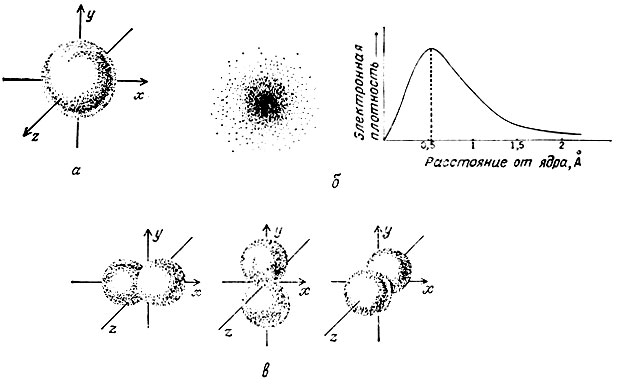
Рис. 1. Распределения электронной плотности для электронов, расположенных на s- и p-орбиталях. а - сферическое распределение s-электронов в пространстве; б - плотность s-электронного облака и ее зависимость от расстояния от ядра; в - распределение в пространстве трех 2p-электронных орбиталей
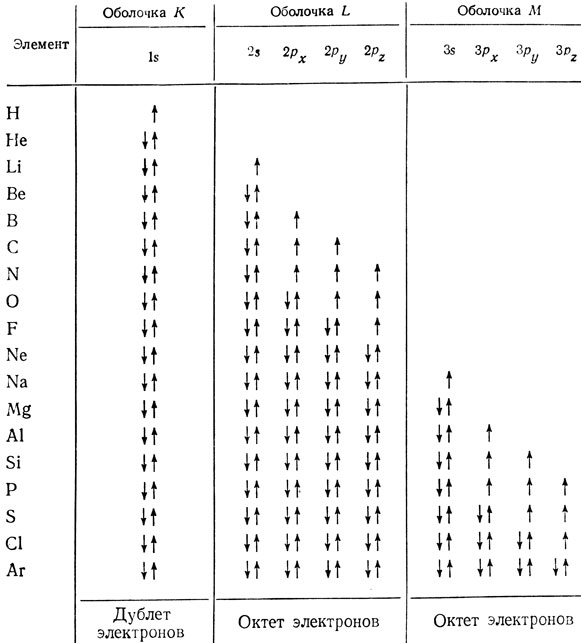
Таблица 2. Электронные конфигурации атомов первых трех периодов периодической системы элементов
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'