
II. Химическая связь
А. Ионная связь
Устойчивость молекул, в которых атомы связаны ионной связью, например хлористого натрия, обусловлена электростатическим взаимодействием положительно заряженного натрия и отрицательно заряженного хлора.
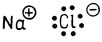
Ионные связи образуются в тех случаях, когда элементы, находящиеся в левой части периодической системы элементов (т. е. электроположительные щелочные и щелочноземельные металлы), реагируют с элементами, находящимися в правой части периодической системы (т. е. неметаллами - кислородом и галогенами). Ионные соединения в твердом состоянии не существуют в виде отдельных молекул, поскольку положительно и отрицательно заряженные ионы образуют ионную решетку.
Американский химик Г. Льюис выдвинул идею об образовании связи за счет спаривания электронов. Он предположил, что атомы становятся особенно стабильными, если они обладают электронной конфигурацией благородных газов. 1s-Электронная орбиталь К-оболочки благородного газа гелия заполнена двумя спаренными электронами (табл. 2). Таким образом, литий и натрий могут достигнуть электронной конфигурации благородных газов гелия и неона, отдавая свои 2s- и 3s-электроны соответственно другим элементам, например галогенам. Принимая эти электроны, галогены также приобретают электронные конфигурации благородных газов: фтор-электронную конфигурацию неона, а хлор - аргона (табл. 2).
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'