
2. π-Связи (кратные связи)
В образовании ненасыщенных соединений участвует другой тип молекулярной связи, при которой максимум электронной плотности наблюдается над и под плоскостью, в которой лежат ядра атомов, образующих связь. Такие связи называют π-связями. Их образование лучше всего иллюстрировать на примерах этилена и ацетилена. В обоих этих случаях гибридизованные орбитали образуют σ-связи, связывающие атомы молекулы. У этилена sp2-гибридизованные орбитали образуют четыре С-Н и одну С-С σ-связи. При этом у каждого атома углерода на p-орбитали остается один неспаренный электрон, как показано на рис. 6, а. Все углы между связями в этилене равны 120°. Все атомы лежат в одной плоскости, а неспаренные электроны расположены выше или ниже этой плоскости. Электронные плотности неспаренных электронов перекрываются. Если спины электронов противоположны, то в результате такого перекрывания может образоваться связь. При этом выше и ниже плоскости, в которой расположены атомы углерода и водорода, образуется делокализованная молекулярная орбиталь, называемая π-связью (рис. 7, а).
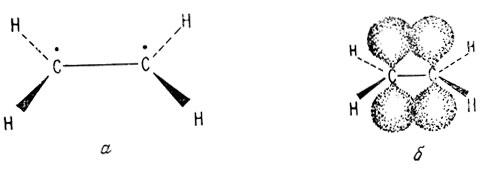
Рис. 6. Схематическое изображение σ- и π-связей этилена. а - σ-связь; б - π-связь

Рис. 7. Схематическое изображение π-связей в этилене (а) и ацетилене (б)
Аналогичные представления применимы и в случае ацетилена, у которого имеется линейная связь, образующаяся в результате sp-гибридизации. Остающиеся неспаренные электроны могут перекрываться выше и ниже, перед и за направлением линейной σ-связи ацетилена. Это приводит к образованию π-связи цилиндрической формы (рис. 7, б).
Существует еще множество классов соединений, содержащих π-связи. Многие из них будут рассмотрены ниже.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'