
Б. Ковалентные связи
1. σ-Связь (простая связь)
Г. Льюис развил также представление о стабильных электронных конфигурациях, образующихся с участием электронов различных атомов. На этом основаны наши современные представления о химической связи большинства органических соединений. Удобно считать, что связывающая молекулярная орбиталь образуется за счет перекрывания двух атомных орбиталей. Так, два атома водорода могут образовать молекулу водорода за счет спаривания обладающих противоположными спинами 1s-электронов этих атомов. На рис. 2 схематически изображен этот процесс.
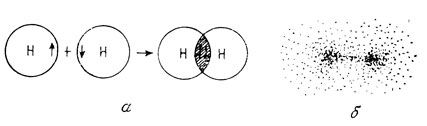
Рис. 2. Схематическое изображение ковалентной связи между двумя атомами водорода в молекуле водорода. а - процесс перекрывания; б - электронная плотность
Связи, образующиеся за счет увеличения электронной плотности между двумя ядрами, называются σ-связями (рис. 2,б). Образование σ-связей возможно также при перекрывании s- и p-орбиталей. Прежде чем обсуждать такие связи, рассмотрим явление гибридизации орбиталей.
Если в образовании связей участвовала электронная конфигурация углерода, изображенная в табл. 2, следовало бы ожидать образования двух ионных или ковалентных связей. Можно представить себе более выгодную электронную конфигурацию, при которой возможно образование четырех ковалентных связей. Один из двух 2s-электронов распаривается и переходит на свободную 2pz-орбиталь. Это требует затраты энергии. Новая тетраэдрическая система орбиталей создается за счет повышения энергии 2s-орбитали и понижения энергии трех 2p-орбиталей. В результате образуются четыре изоэнергетические орбитали, энергии которых лежат между энергиями s- и p-орбиталей:
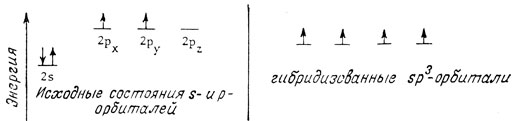
В соответствии с правилом Гунда на каждой гибридизованной орбитали находится только один электрон. В итоге небольшая затрата энергии, требуемая для образования sp3-гибридизованных орбиталей, окупается энергией, выделяемой при образовании четырех ковалентных связей. При образовании четырех σ-связей с такими атомами, как водород, освобождается 397 ккал/моль. При образовании двух связей за счет исходных негибридизованных p-орбиталей углерода следовало бы ожидать максимум 198 ккал/моль. Таким образом, гибридизация является благоприятным процессом, поскольку в конечном счете при гибридизации высвобождается энергия.
Образующиеся sp3-орбитали симметрично ориентированы относительно осей координат и направлены к вершинам тетраэдра, как показано на рис. 3.
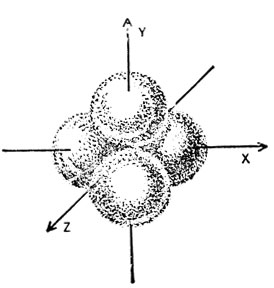
Рис. 3. Схематическое изображение пространственной ориентации sp3-гибридизованных орбиталей
Возвращаясь к структуре σ-связей, мы видим, что электроны могут участвовать в заполнении гибридизованных орбиталей практически так же, как и электроны атомов водорода (рис. 2). Изолированная sp3-орбиталь ориентирована в пространстве так, как это изображено на рис. 4, а. Большая часть электронной плотности сосредоточена по одну сторону от ядра, и лишь небольшая ее часть находится по другую сторону. Связывание происходит за счет перекрывания орбиталей так, что электроны обобществляются.
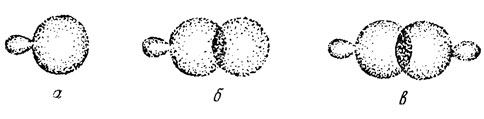
Рис. 4. Схематическое изображение изолированной sp3-орбитали (а) и ее перекрывания с s-орбиталью (б) и другой sp3-гибридизованной орбиталью (в)
Другие элементы также могут образовывать σ-связи. У бериллия гибридизуется s- и p-орбиталь, и в результате этого образуются линейные молекулы. У бора гибридизуется одна s- и две p-орбитали, образуя плоские соединения с углом между связями 120°, как показано на рис. 5.
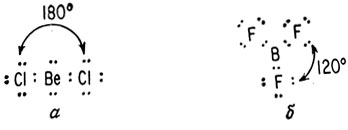
Рис. 5. Схематическое изображение σ-связи в соединениях бериллия (а) и бора (б)
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'