
2. Карбонильные группы
Для формальдегида положение несколько иное. У формальдегида нет гидроксильной группы (группы О-Н), как у воды и метилового спирта, поэтому он не может образовать водородную связь с другой молекулой формальдегида. Однако он содержит полярную двойную связь углерод-кислород. Благодаря этому молекула формальдегида может связываться водородной связью с другими молекулами, содержащими О-Н-группу.
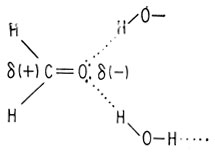
Углерод и кислород, связанные двойной связью, образуют группу, называемую карбонильной. Геометрия связи такая же, как и у углерод-углеродной двойной связи, т. е. углы между связями в формальдегиде составляют 120° и все атомы лежат в одной плоскости.
Следующая молекула в рассматриваемом ряду, муравьиная кислота, содержит и гидроксильную и карбонильную группы. Такая комбинация у одного и того же углеродного атома называется карбоксильной группой, а соединение, включающее такую группу, - карбоновой кислотой. Карбоксильная группа вовлекается в образование сильной водородной связи между двумя молекулами.
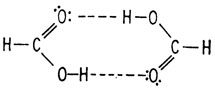
Соединения, содержащие карбоксильную группу, также весьма гидрофильны, поскольку они содержат гидрофильные группы, входящие как в метиловый спирт, так и в формальдегид.
Такая особая комбинация атомов кислорода у одного и того же атома углерода сообщает молекуле специфическую способность освобождать протон (Н+) гораздо легче, чем вода. Соединение, являющееся более сильным донором протона, чем вода, называют кислотой; отсюда название "муравьиная кислота".
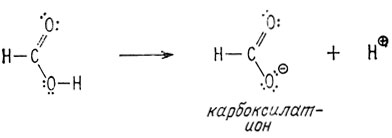
Основной причиной, обусловливающей кислотность карбоксильной группы, является то, что после отделения протона образуется весьма стабильный отрицательно заряженный карбоксилат-ион
Стабильность карбоксилат-иона обусловлена тем, что отрицательный заряд равномерно распределяется на оба атома кислорода. Поэтому точнее изображать карбоксилат-ион так, как будто каждый атом кислорода несет на себе половинный заряд и связан с атомом углерода равноценными связями, являющимися промежуточными между простой и двойной связью.
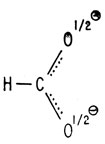
Реально существующий карбоксилат-ион
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'