
1. Водородная связь
Вследствие взаимного притяжения зарядов противоположного знака атом кислорода одной молекулы воды притягивается к атому водорода другой молекулы воды. Такая межмолекулярная ассоциация, известная как водородная связь, создает довольно прочную трехмерную решетку, чем и объясняются высокие температуры кипения таких соединений, как вода и метиловый спирт.
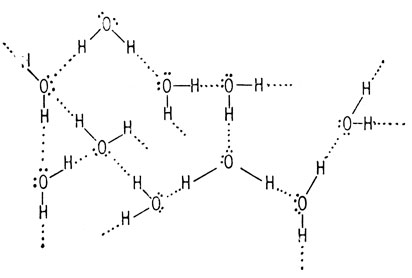
Водородные связи между молекулами воды
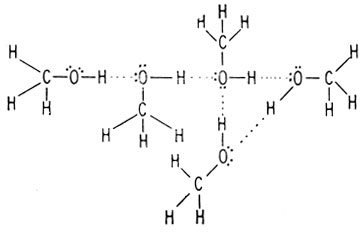
Водородные связи между молекулами метилового спирта
Молекулы воды и метилового спирта могут также ассоциировать друг с другом, что обусловливает их взаимную растворимость.
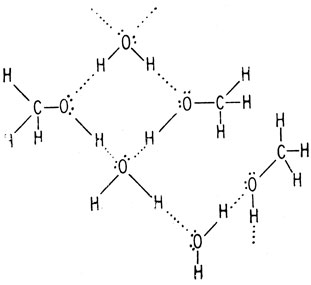
Способность ассоциироваться с молекулами воды называется гидрофильностью. Метан такой способностью не обладает и поэтому называется гидрофобным. Поскольку электроотрицательности атомов водорода и углерода близки, связи углерод-водород обладают незначительной полярностью и межмолекулярная ассоциация слаба. Этим обусловлена низкая температура кипения метана по сравнению с температурами кипения воды и метилового спирта.
Водородная связь допускает также обмен иона водорода между молекулами. В изображенной выше ассоциации водородные атомы не принадлежат какому-либо определенному атому кислорода. Поскольку ион водорода представляет собой просто протон, он весьма подвижен и за счет водородной связи может перемещаться от одной молекулы к другой почти без затруднений.
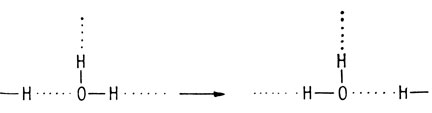
Обмен протонами за счет водородных связей
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'