
4. Двуокись углерода
Двуокись углерода также является кислородсодержащим производным метана. Это соединение имеет четыре связи углерод-кислород (две σ-связи и две π-связи) и соответствует поэтому максимально возможной степени окисления атома углерода. При полном сгорании органического соединения каждый атом углерода превращается в молекулу двуокиси углерода. Таким образом легко определить, сколько углерода содержится в исследуемом образце органического соединения - нужно просто сжечь этот образец и взвесить образовавшуюся при сжигании двуокись углерода. Вес атомов углерода образца равен весу двуокиси углерода, умноженному на отношение С/СО2, которое равно 12/44.
Сходство двуокиси углерода с формальдегидом в том, что обе молекулы содержат карбонильные группы и не содержат гидроксильных. Таким образом, СО2 может образовывать водородные связи только с соединениями, содержащими О-Н-группы. Как и формальдегид, СО2 является гидрофильным соединением. При растворении двуокиси углерода, которая при комнатной температуре является газом, в воде образуется нестабильный гидрат, обычно называемый угольной кислотой.
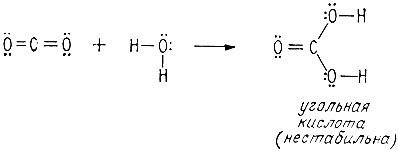
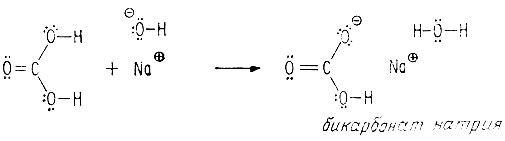
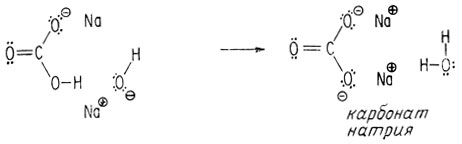
Как и в случае приводившихся ранее молекул - метиленового диалкоголя, метанового триалкоголя и тетраалкоголя углерода, - угольная кислота нестабильна, поскольку она имеет у одного атома углерода более одной гидроксильной группы. Однако натриевые соли угольной кислоты - бикарбонат натрия и карбонат натрия - стабильны и их можно выделить.
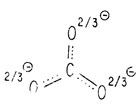
Как и карбоксилат-ион, анион карбоната CO2-3 стабилизован за счет резонанса, что обычно изображают при помощи обоюдоострых стрелок между реально несуществующими предельными структурами.
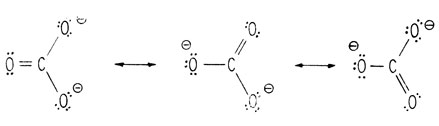
Изображение резонанса в карбонат-анионе
В действительности этот катион содержит три одинаковые связи углерод-кислород, промежуточные между простой и двойной связью, а каждый атом кислорода несет одинаковую долю отрицательного заряда иона. Такой анион является плоским, а угол между связями равен 120°.
Сама двуокись углерода представляет собой линейную молекулу, поскольку атом углерода участвует в образовании двух π-связей, как в ацетилене. Отдельные связи углерод-кислород поляризованы обычным образом, однако вследствие того, что молекула линейна, полярности каждой связи направлены навстречу друг другу и в целом молекула неполярна.
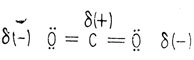
Поляризация связей в двуокиси углерода
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'