
В. Связь углерод-азот
Введение в молекулу метана атомов азота приводит к образованию нового ряда соединений, свойства которых отличны от свойств производных, содержащих атом кислорода. Атом азота имеет на валентной оболочке пять электронов, и для ее заполнения ему нужно еще три электрона. Поэтому валентность азота равна трем и он может образовать простую, двойную и тройную связи.
Электроотрицательность атома азота больше, чем электроотрицательность атома углерода или водорода, но меньше, чем атома кислорода, поскольку электроотрицательность атомов в периодической системе элементов возрастает слева направо.
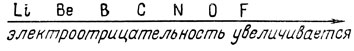
Это означает, что связи углерод-азот и водород-азот являются полярными связями. Как правило, азотсодержащие соединения гидрофильны, так же как и кислородсодержащие.
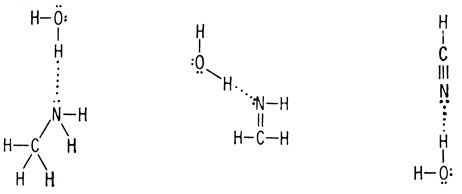
Однако меньшая электроотрицательность атома азота по сравнению с атомом кислорода приводит к тому, что производные, содержащие атом азота, во многом отличаются от производных, содержащих атом кислорода. Во-первых, эти отличия объясняются тем, что атом кислорода более прочно удерживает электроны, чем атом азота. Это обусловлено более высоким положительным зарядом ядра кислорода. Поэтому неподеленная пара электронов атома азота легче образует связь, чем неподеленная пара атома кислорода.
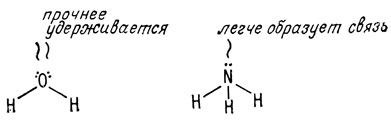
Атом кислорода является более электроотрицательным и прочнее удерживает электроны, чем атом азота
На практике в результате этого атом азота, как правило, является более основным и более нуклеофильным, чем атом кислорода. Основность и нуклеофильность тесно связаны друг с другом. Основность - это легкость, с которой атом отдает свою неподеленную пару электронов для образования связи, а нуклеофильность - это способность атаковать положительно заряженный центр парой электронов.
Так, при добавлении сильной кислоты, например HCl, к раствору аммиака в воде получается больше ионов аммония, чем гидроксония. Более сильное основание (аммиак) захватывает больше протонов, чем более слабое основание (вода).
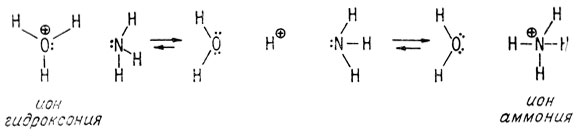
Равновесие сдвинуто в сторону образования иона аммония, а не гидроксония
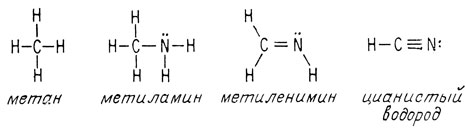
Геометрия производных метана, содержащих атом азота, аналогична геометрии соответствующих производных, содержащих атом кислорода. Углы между связями в метиламине близки к тетраэдрическому (109°). Метиленимин представляет собой плоскую молекулу с углами между связями, равными 120°. Цианистый водород с его двумя π-связями атома углерода является линейной молекулой, как ацетилен и двуокись углерода.
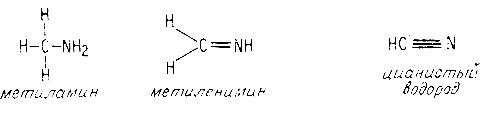
В табл. 6 приведены энергии связей различных типов, рассмотренных нами. Эта сводная таблица ясно показывает, что природа I связи влияет на ее реакционную способность,
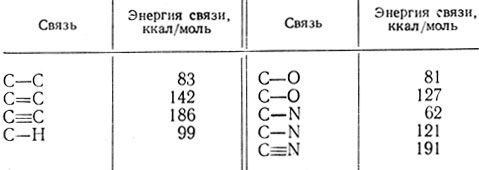
Таблица 6. Энергии типичных связей органических соединений
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'