
А. Химические изомеры
В начале XIX в. химиков весьма озадачивало, почему соединения, имеющие одинаковые эмпирические формулы, обладают столь различными свойствами. Например, диметиловый эфир и этанол оба имеют эмпирическую формулу С2Н6О и мол. вес 46. Их свойства, однако, заметно отличаются. Диметиловый эфир - газ с т. кип. - 24°С, а этанол - жидкость с т. кип. 79°С.
В классической работе, опубликованной в 1858 г., Кекуле предложил объяснение, почему химические изомеры могут обладать столь различными свойствами. Принимая во внимание наблюдение, сделанное английским химиком Эдвардом Франклином о том, что каждый атом может присоединять лишь определенное число других атомов, Кекуле постулировал, что валентность углерода должна быть равна четырем. Далее он предположил, что атомы углерода могут соединяться друг с другом, образуя цепи. Впервые эта идея пришла Кекуле во сне, когда он задремал в омнибусе. Позже он так описывал этот сон:
"Атомы плясали у меня перед глазами. И раньше, когда бы эти крошечные частицы ни появлялись передо мной, они всегда были в движении. Теперь, однако, я видел, как два атома меньшего размера соединялись, образуя пару, как атом большего размера заключал два меньших атома в объятия, а атомы еще большего размера удерживали вместе по три или даже по четыре меньших атома, и при этом все они вместе продолжали двигаться в головокружительном танце. Я видел, как атомы большего размера образовывали цепи, увлекая за собой атомы меньшего размера... Восклицание кондуктора "Клэнхэм Роуд" пробудило меня...".
Так родилось представление о химической связи. Кекуле стал изображать связи между атомами при помощи черточек и постулировал, что химические изомеры возникают в результате связывания атомов разными способами. Например, структурные формулы химических изомеров - упоминавшихся выше этанола и диметилового эфира - можно представить следующим образом:
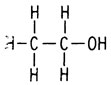
Этанол
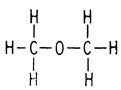
Диметиловый эфир
Для того чтобы объяснить структурные формулы некоторых молекул, Кекуле было введено представление о двойных и тройных связях. Двуокись углерода, например, должна иметь две двойные связи. Атом азота в цианистом водороде должен быть связан с атомом углерода
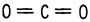
Двуокись углерода
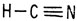
Цианистый водород
Структурные формулы Кекуле давали двумерное изображение молекулы. В 1874 г. два химика, Вант-Гофф и Ле Бель, независимо предложили рассматривать атом углерода как трехмерный объект. Согласно этому представлению, углерод изображается в виде тетраэдра, к вершинам которого направлены его связи. Простую, двойную и тройную углерод-углеродные связи можно, таким образом, представить как соединение тетраэдров вершинами, ребрами и гранями с находящимся в центре каждого из них атомом углерода
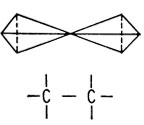
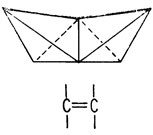
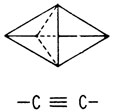
Другой проблемой, вызывавшей недоумение у химиков XIX в., было наличие двух сильно отличающихся друг от друга классов органических соединений: жирных (алифатических) и ароматических. Соединения, относящиеся к первой группе, сравнительно устойчивы; это мыла, спирты и смазочные материалы. Ароматические соединения обычно легко летучи и обладают запахом. Они всегда содержат по крайней мере шесть атомов углерода и характеризуются более высоким содержанием атомов углерода по отношению к другим атомам, чем алифатические соединения.
В 1864 г. Кекуле предложил объяснение строения ароматических соединений. Как и в случае химической связи, впервые эта идея пришла ему во сне. Он писал:
"Я сидел и писал учебник, "о что-то мне мешало и мысли мои где-то витали. Я придвинул кресло к камину и задремал. Атомы принялись танцевать перед моими глазами. На этот раз маленькие группы скромно держались на втором плане. Мой мысленный взор, обостренный от повторения одних и тех же образов, мог теперь различить структуры большего размера в разнообразных конфигурациях. Длинные цепи очень часто сближались, все они изгибались и поворачивались, подобно змеям. Но что это? Одна из змей вцепилась в собственный хвост и насмешливо закружилась перед моими глазами. Как от вспышки молнии, я пробудился; остаток ночи я провел, обдумывая следствия моей гипотезы".
Кекуле постулировал, что в основе ароматических соединений лежит бензольное кольцо, образуемое соединением шести атомов углерода. Поскольку эмпирическая формула бензола С6Н6 была известна, Кекуле предположил, что структурную формулу можно представить одним из двух способов:
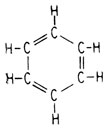
или
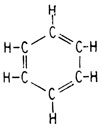
Часто для простоты ее изображают сокращенно:
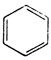
или
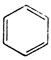
Атомы углерода, входящие в молекулу бензола, принято нумеровать, как показано ниже:
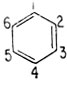
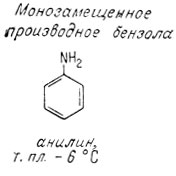
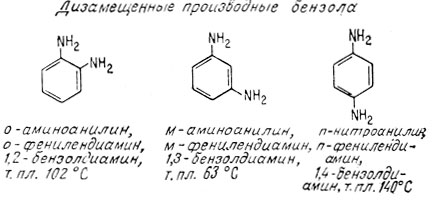
Согласно Кекуле, поскольку все углеродные атомы в бензольном кольце равноценны, замещение любого водородного атома любой группой (например, -ОН, -NH2, -СН3) приводит к одному и тому же монозамещенному продукту. Однако могут существовать три дизамещенных продукта в зависимости от относительного положения замещающих групп. Замещающие группы могут находиться у соседних углеродных атомов (орто-положение), через один атом углерода (мета-положение) или у противоположных атомов углерода (пара-положение). Ниже приведены различные названия одних и тех же дизамещенных производных бензола. Интересно отметить различие в температурах плавления дизамещенных продуктов, которые все отвечают одинаковой эмпирической формуле.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'