
2.8. Транспорт при участии переносчиков: молекулярные механизмы
Любое объяснение на молекулярном уровне явления трансмембранного транспорта при участии переносчиков должно учитывать тот факт, что в качестве переносчиков выступают специфические белковые компоненты клетки. Роль этих белковых компонентов наиболее ярко проявляется в генетическом контроле транспортных систем. Дефект в системе кодирования одного из этих белков приводит к специфическим нарушениям в транспортной системе. Многие дефицитные по способности к транспорту мутанты найдены среди бактерий. Некоторые системы транспорта можно индуцировать в таких бактериях, если в культуральную среду, на которой выращивают бактерии, поместить новый субстрат; через некоторый лаг-период появляется так называемая пермеазная активность.
ТАБЛИЦА 2
Сравнение нормальных мутантов и мутантов, дефицитных по транспорту какого-либо соединения

Возникновение пермеазной активности, а также появление отдельных молекулярных компонентов пермеазы блокируются ингибиторами биосинтеза белка. Эти индуцируемые пермеазы позволили получить весьма ценные сведения о молекулярных компонентах системы транспорта у бактерий. У человека идентифицировано более двадцати "транспортных болезней"; однако молекулярная природа недостающих компонентов в транспортной системе до сих пор еще не выяснена. Приведем некоторые примеры генетических нарушений транспортных систем у человека:

Пытаясь описать молекулярные механизмы, лежащие в основе транспорта веществ через мембрану при участии переносчиков (рис. 44), мы должны найти те или иные критерии, которые позволят идентифицировать отдельные компоненты (стадии) процесса. В целом процесс можно представить таким образом: специфическое узнавание и связывание транспортируемого вещества с переносчиком, последующая его транслокация через мембрану на небольшое, но неизвестное расстояние и, наконец, диссоциация комплекса вещество - переносчик. Если в распоряжении исследователя имеются специфические ингибиторы системы транспорта, то можно наблюдать их связывание с переносчиками. В системах, где движение веществ осуществляется против концентрационных градиентов, должны действовать механизмы, обеспечивающие связь транспортного процесса с метаболической энергией (АТФазная активность и т. д.). Специфическое связывание и зависимость от энергетических процессов служат удобными критериями для идентификации компонентов транспортной системы. Так как при разделении компонентов транспортной системы нарушаются их пространственные взаимоотношения, стадия транслокации является наименее доступной для изучения.
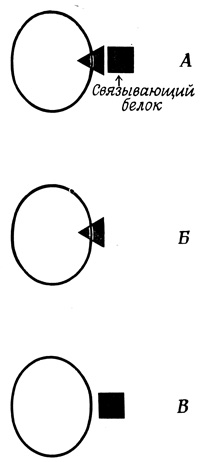
Рис .44. Роль связывающих белков в проникновении веществ через мембраны. А - быстрое проникновение; Б, В - медленное проникновение
Ряд связывающих белков, осуществляющих специфический перенос различных молекул, был выделен из клеток бактерий с использованием метода осмотического шока. Участие этих связывающих белков в транспортных системах представляется весьма вероятным по следующим причинам: 1) константы связывания веществ связывающими белками близки соответствующим величинам, полученным при изучении кинетических параметров транспорта тех же веществ; 2) существуют "транспортно-негативные" мутанты, дефицитные по связывающему белку, но нормальные во всех прочих отношениях; 3) индукция транспортной активности приводит к появлению специфического связывающего белка; 4) некоторые соединения, блокирующие транспорт и активность связывающих белков, делают это, не проникая в клетку; 5) добавление очищенных связывающих белков к клеткам, утратившим транспортную активность (например, в результате осмотического шока), приводит к восстановлению этой активности.
Для экспоненциально делящихся клеток характерна более высокая транспортная активность и связывающая способность, чем для клеток, переставших делиться. Однако выделить связывающие белки из делящихся клеток сложнее, чем из неделящихся. Это объясняется, по-видимому, более прочным соединением связывающих белков с другими компонентами транспортной системы в делящихся клетках. Совершенно очевидно, что, помимо связывающих белков, не принимающих непосредственного участия в процессах трансформации энергии (не обладающих АТФазной активностью), в состав транспортных систем входят и другие компоненты. Необходимость в других компонентах для этих систем подтверждается существованием мутантов, имеющих связывающие белки, но не способных к транспорту.
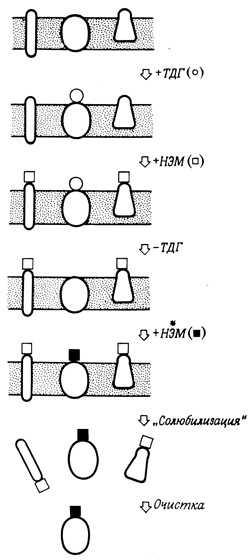
Рис. 45. Схема 'солюбилизации' и очистки ассоциированного с мембранами связывающего белка, содержащегося в индуцибельной β-галактозидпермеазной системе Е. coli
Ассоциированный с мембраной связывающий белок выделен из индуцибельной β-галактозидпермеазной системы E. coli (рис. 45). Эта система переносит через мембрану различные β-галактозиды, причем процесс ингибируется N-этилмалеимидом (НЭМ). Для защиты связывающих центров пермеазы во время интенсивной реакции белков клеточной мембраны с НЭМ использовали тиодигалактозид (ТДГ), который транспортируется пермеазой через мембрану, но не метаболизируется в клетке. После удаления из реакционной смеси ТДГ и непрореагировавшего НЭМ клетки вновь обрабатывали радиоактивным НЭМ. Этот радиоактивный НЭМ взаимодействовал с незащищенными теперь центрами пермеазы. В результате радиоактивная метка включалась в один-единственный белок (М-белок), причем включение это наблюдалось только у бактерий с индуцированным транспортом, т. е. в том случае, когда в мембранной системе присутствовала пермеаза. М-белок, оказавшийся компонентом бактериальной мембраны, был переведен в растворимое состояние и очищен. Более подробное изучение свойств этого белка затруднялось тем, что меченый НЭМ необратимо модифицировал связывающий центр. Используя сходную методику, удалось идентифицировать, а также выделить в виде НЭМ-производного глюкозосвязывающий белок из мембран микроворсинок, расположенных в клетках коры почек крысы.
Когда транспортная система должна повышать концентрацию транспортируемого вещества, сопровождающие транспортный процесс ферментативные реакции, связанные с превращениями энергии, служат удобным критерием, позволяющим выделять и изучать отдельные компоненты этой транспортной системы. Например, фосфоенолпируватную фосфотрансферазную систему для транспорта сахаров удалось разделить на несколько компонентов (рис. 46). Растворимый фермент (фермент I) фосфолирует небольшой растворимый белок (HPr) за счет фосфоенолпирувата (ФЕП). Этот фосфорилированный белок используется затем как донор фосфата вторым ферментом (фермент II), который превращает внеклеточный сахар во внутриклеточный фосфат сахара. Некоторые мутанты, дефицитные по ферменту I или HPr, не способны фосфорилировать сахара, транспортируемые в обычных условиях этой системой. Другие мутанты, характеризующиеся нормальным содержанием фермента I и HPr, также утрачивают способность фосфорилировать индивидуальные сахара. Из этого следует, что специфичность в узнавании сахаров присуща ферменту II и что эти последние мутанты потеряли определяемую ферментом II специфичность в отношении индивидуальных сахаров. Фермент II прочно связан с мембраной, и его центр связывания сахаров должен быть доступен для молекул сахаров на внешней поверхности мембраны. Фосфорилированные сахара освобождаются на внутренней поверхности мембраны. HPr и фермент I представляют собой растворимые белки и функционируют, вероятно, на внутренней поверхности мембраны. Векторный характер этого процесса утрачивается в присутствии ионов фтора. В этом случае фосфорилирование сахаров все же происходит, но они высвобождаются во внешнюю среду.
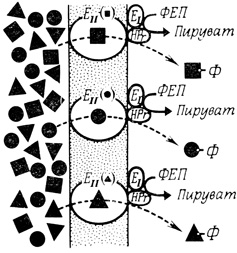
Рис. 46. Компоненты фосфотрансферазной системы переноса сахаров
Транспортные АТФазы, содержащиеся в животных тканях, прочно связаны с мембранами, проявляют высокую специфичность и катализируют ферментативные реакции, протекание которых находится в строгой зависимости от направлений подхода к мембране субстрата и транспортируемых веществ.
В случае (Na++K+) - зависимой АТФазы (рис. 47) ферментативная и транспортная активность наблюдается лишь в присутствии Mg2+, АТФ и Na+ на внутренней поверхности мембраны и К+ - на наружной поверхности. Уабаин ингибирует реакцию только на внешней стороне мембраны, и его ингибирующий эффект ослабляется "внешним" К+. Используя в качестве субстрата 32Р-АТФ, можно наблюдать фосфорилирование фермента, в результате которого образуется 32Р-производное остатка глутаминовой кислоты. Образование фосфорилированного промежуточного продукта протекает в присутствии Na+. Гидролизу этого промежуточного продукта способствуют ионы К+, а ингибируется этот процесс уабаином. АТФаза прочно связана с мембраной. Выделение и очистка АТФазы сопряжены со значительными трудностями, поскольку ее активность утрачивается уже на стадии получения солюбилизированных экстрактов. В состав наиболее высокоочищенных препаратов фермента (из коры почек собаки) входят два главных полипептида: один - с молекулярным весом около 135 000 и с высоким содержанием аминокислот с неполярными боковыми цепями и другой, сиалогликопептид, - с молекулярным весом 40 000. Более высокомолекулярный полипептид обладает свойствами, характерными для АТФазы, фосфорилируется АТФ и несет центры связывания уабаина и его аналогов. Функциональная роль низкомолекулярного гликопептида пока еще неясна. Если высокомолекулярный полипептид имеет in situ сферическую форму, то его диаметр должен составлять около 70Å, т. е. несколько превышать ширину гидрофобного слоя мембраны. Возможно, что этот полипептид прошивает мембрану насквозь, так что его центр фосфорилирования лежит на внутренней поверхности мембраны, а центр связывания уабаина - на внешней поверхности.
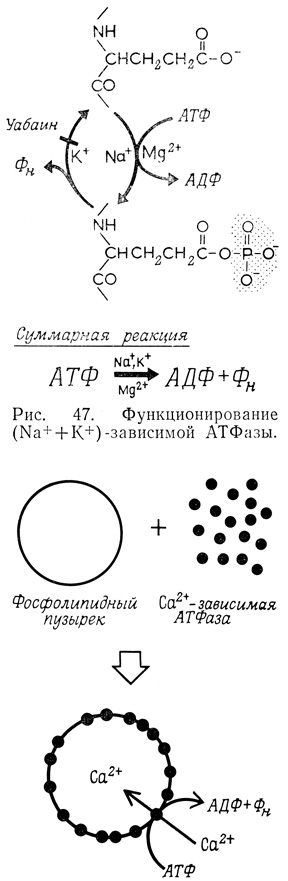
Рис. 47. Функционирование (Na++K+)-зависимой АТФазы. Рис. 48. Образование фосфоли пидных пузырьков и накопление в них ионов Са2+
Очищенные препараты АТФазы содержат фосфолипиды. Обработка фосфолипазами или органическими растворителями как "солюбилизированной", так и связанной с мембраной форм АТФазы приводит к инактивации фермента. В определенных условиях при добавлении фосфолипидов активность может восстановиться. Это позволяет предположить, что фосфолипиды необходимы для нормального функционирования фермента и транспортной системы.
Са2+-зависимая АТФаза, сопряженная с мощным кальциевым насосом, локализована в мембранах саркоплазматической сети и имеет некоторые сходные черты с (Na++K+)-АТФазой, сопряженной с натриевым насосом. В обоих случаях субстратом АТФазной реакции служит Mg2+-АТФ. Механизм АТФазной реакции Са2+-зависимой АТФазы включает образование фосфорилированного промежуточного продукта (в присутствии Са2+) и его последующий гидролиз. Препарат Са2+-зависимой АТФазы был "солюбилизирован" и очищен. В составе этого фермента обнаружили белок с молекулярным весом 100 000 и относительно высоким содержанием аминокислот с неполярными боковыми цепями. Для работы Са2+-зависимой АТФазы также необходимо присутствие фосфолипидов: их удаление приводит к инактивации фермента, а последующее добавление - к восстановлению ферментативной активности. В определенных условиях в смеси очищенного препарата Са2+-зависимой АТФазы и фосфолипидов образуются пузырьки, в которых накапливаются ионы Са2+ и которые в этом отношении очень напоминают пузырьки саркоплазматической сети (рис. 48).
Наличие в мембране ферментативной активности, сопряженной с транспортом, а также уровень этой активности определяются специализацией данной мембраны. В мембране эритроцитов, например, содержание (Na++К+)-зависимой АТФазы составляет менее 1% общего белка, в мембране микросом почек содержание этого фермента превышает 10%, а в мембране электрического органа рыб его содержание может быть еще выше. На долю Са2+-зависимой АТФазы саркоплазматической сети приходится 60% общего белка мембраны.
Данные, касающиеся свойств белков (или липопротеидов), непосредственно участвующих в механизмах транспорта, играют огромную роль в понимании природы транспортных процессов; однако на основании этих данных невозможно во всех деталях воссоздать картину, описывающую транспортный процесс в целом. Наиболее неясной остается сама стадия переноса через мембрану. Каким образом транспортируемые молекулы присоединяются к связывающим центрам мембранных белков, чтобы пересечь мембрану? Этот вопрос мы обсудим далее в гл. 6.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'