
3.3. Обмен информацией между клетками
Интеграция активности отдельных клеток в единую систему целого организма предполагает непрерывный обмен информацией между ними. Информация может передаваться в форме потенциала действия или путем изменения химических свойств среды, окружающей клетки. Эти изменения могут касаться концентрации "нормальных" компонентев, таких, как ионы или метаболиты, например глюкоза, или особых молекул, таких, как гормон или нейромедиаторы.
Потенциал действия осуществляет передачу простой единицы информации в пределах одной клетки. В отдельных случаях потенциал действия может передаваться через электрический синцитий, который на электронных микрофотографиях выглядит как ограниченная область тесного контакта между двумя трехслойными структурами соседних клеток. Такие электрические синцитии были обнаружены в сердечной мышце беспозвоночных и в сегментированных перегородках гигантского аксона беспозвоночных (рис. 65).
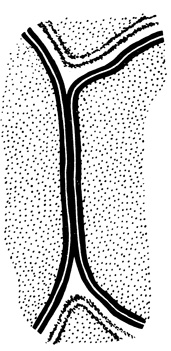
Рис. 65. Электрический синцитий
Большинство контактов (синапсов) между нервными окончаниями и другими клетками имеет щель, ширина которой (на микрофотографиях - расстояние между двумя трехслойными структурами) составляет 15 нм и более. Передача информации через такие синаптические контакты между клетками осуществляется с помощью химических медиаторов, формулы которых приведены ниже:
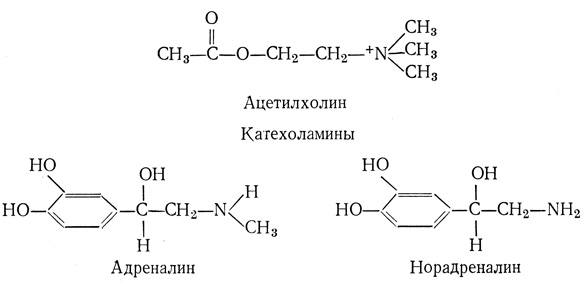
Нервные окончания выделяют в область синаптической щели особые вещества - нейромедиаторы (ацетилхолин, катехоламины и некоторые аминокислоты). Далее эти вещества вступают во взаимодействие с плазматической (постсинаптической) мембраной другой клетки (рис. 66). Затем медиаторы инактивируются - либо расщепляясь (например, гидролиз адетилхолина ацетилхолинэстеразой), либо поглощаясь нервными окончаниями (например, норадреналин).
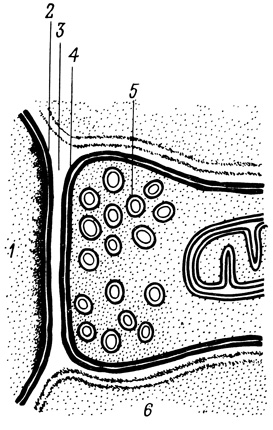
Рис. 66. Схематическое изображение синапса. 1 - нейрон; 2 - постсинаптическая мембрана; 3 - синаптическая щель; 4 - пресинаптическая мембрана; 5 - синаптические пузырьки; 6 - глиальная клетка
Явление передачи нервного импульса с участием медиатора изучено наиболее подробно на примере особых соединений между аксонами и мышечными клетками. В области таких нервно-мышечных соединений кончик аксона делится на несколько концевых волокон небольшого диаметра, уложенных в точно пригнанные бороздки, лежащие на небольшом участке поверхности мышечной клетки. Эти участки называют концевыми пластинками. В области контакта с нервными окончаниями мембрана мышечной клетки (сарколемма) образует сложные извилины (рис. 67).
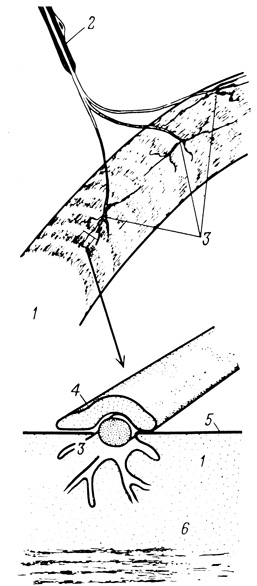
Рис. 67. Схема нервно-мышечного соединения. 1 - мышечное волокно; 2 - нерв; 3 - концевые пластинки; 4 - шванновская клетка; 5 - сарколемма; 6 - миофибриллы
Ацетилхолин выделяется из нервного окончания в щель нервно-мышечного соединения и вступает во взаимодействие с мембраной мышечного волокна. В результате этого взаимодействия примерно через 0,7 мс генерируется потенциал концевой пластинки. Если этот потенциал превышает критический уровень, возникает потенциал действия, который распространяется на всю поверхность мышечного волокна. Эксперименты по нанесению ацетилхолина с помощью микропипетки непосредственно на область концевой пластинки показали, что 10-15-10-16 М ацетилхолина достаточно для возбуждения мышечного волокна.
Ацетилхолин хранится в пресинаптических нервных окончаниях в небольших синаптических пузырьках (диаметром 30-60 нм) и выделяется в синаптическую щель нервно-мышечного соединения путем экзоцитоза (гл. 4). Процесс выделения ацетилхолина запускается потенциалом действия, приходящим к нервному окончанию. Однако даже в отсутствие этого стимула на двигательных концевых пластинках происходят небольшие спонтанные колебания мембранного потенциала (порядка 0,4 мВ). Эти изменения потенциала (миниатюрные потенциалы концевой пластинки) можно объяснить нерегулярным спонтанным выделением в синаптическую щель небольших порций (квантов) ацетилхолина (10-18 М).
Функционирование нервно-мышечного соединения представляет пример простой однонаправленной передачи нервного импульса к мышечным волокнам. В центральной нервной системе взаимоотношения между стимулом и реакцией (или реакциями) осуществляются по значительно более сложному механизму. Например, к телу одной нервной клетки сходятся сотни нервных окончаний, часть которых выделяет возбуждающие медиаторы, а часть - тормозные. Если в итоге возникает эффект торможения, это означает, что мембранный потенциал "уходит" от порогового потенциала. Преобладание медиаторов возбуждения приближает мембранный потенциал к порогу деполяризации, в результате чего возникает потенциал действия.
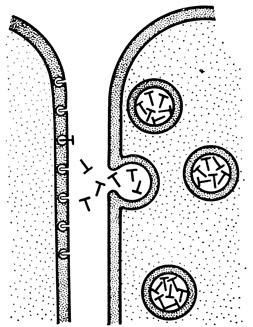
Рис. 68. Передача возбуждения с помощью химического воздействия
Передача информации клетками с помощью химических воздействий (рис. 68) не сводится лишь к системе нейромедиаторов с их локальным действием. Многие химические посредники (гормоны), выделяемые анатомически обособленными структурами - эндокринными железами, - переносятся по системе кровообращения к определенным клеткам-мишеням, с которыми они взаимодействуют.
Если некоторые физиологически активные молекулы, например стероидные гормоны, для проявления своей активности проникают в клетку, то для другого типа гормонов, согласно современным представлениям, в этом нет необходимости. Так, инсулин и адреналин сохраняют способность вызывать характерную реакцию клетки-мишени, даже если их "привязать" к таким крупным частицам, как стеклянные шарики или гранулы сефарозы. Из подобных экспериментов следует, что поверхность клеток обладает особой системой "рецепторов", способной улавливать изменения в окружающей среде и вызывать ответные процессы в клетке, которые приводят к изменению проницаемости мембраны, изменению метаболизма или же изменению механо-химических свойств внутриклеточных систем (рис. 69).
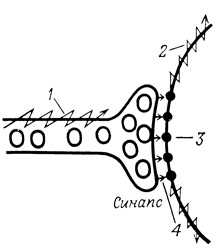
Рис. 69. Система рецепторов на поверхности клетки, способная улавливать изменения в окружающей среде и вызывать ответные процессы в клетке. 1 - импульс в нерве; 2 - распространение нового потенциала действия; 3 - рецепторы; 4 - высвобождение нейромедиаторов
Эффект многих гормонов опосредован их влиянием на активность такого связанного с рецепторами фермента, как аденилатциклаза. В результате взаимодействия гормона с мембраной внутри клетки вырабатывается "второй посредник" ("первым" является гормон), например циклический аденозин-3′, 5′-монофосфат (циклический АМФ), который служит внутриклеточным передатчиком гормона (рис. 70).
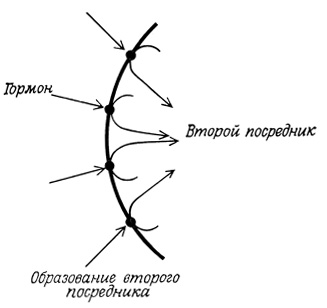
Рис. 70. Образование второго посредника
Некоторые гормоны, индуцируя синтез второго посредника, одновременно вызывают и изменение проницаемости клетки-мишени. Такие нейромедиаторы, как дофамин и ацетилхолин, не только изменяют проницаемость клетки, но и влияют на содержание в ней второго посредника. Норадреналин - гормон мозгового вещества надпочечников - является одновременно и нейромедиатором. Это указывает на сходство в механизме действия гормонов и нейромедиаторов. Разница, по-видимому, в том, что нейромедиаторы действуют быстро и локально, а действие гормонов осуществляется медленно и носит общий характер.
До недавнего времени информацию о природе и распределении рецепторных участков на поверхности клеток получали главным образом из экспериментов по изучению лигандов, ингибирующих (антагонисты) или имитирующих (агонисты) действие природных физиологически активных веществ. Молекулы таких лигандов связываются с теми же участками мембраны, что и гормоны или нейромедиаторы, поэтому изучение зависимости активности лигандов от их структуры позволяет получить ценные данные о специфичности рецепторов (рис. 71). Подобные фармакологические исследования выявили (иногда даже на поверхности одной и той же клетки) по два или несколько различных типов рецептора для одного агониста. Например, адреналин действует через α- и β-рецепторы, а ацетилхолин - через никотиновые и мускариновые.
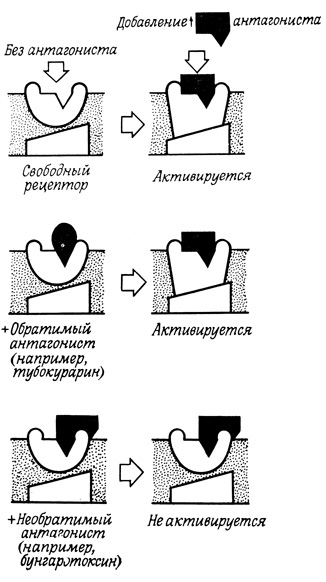
Рис. 71. Действие антагонистов на активацию рецепторных участков на поверхности клетки
Некоторые соединения обратимо ингибируют действие ацетилхолина на скелетные мышцы и электрогенные ткани (последние развились у электрических рыб из мышечной ткани, утратившей свою сократительную функцию). Для полного паралича мышцы достаточно такого количества d-тубокурарина (действующее начало яда кураре, которым пользовались индейцы при изготовлении отравленных стрел), которого хватает лишь на образование мономолекулярного слоя всего на 1 % поверхности нервно-мышечных соединений (рис. 72). В этих условиях холинэргические рецепторы оказываются полностью насыщенными d-тубокурарином. К сожалению, этот антагонист связывается и с другими белками (например, с ацетилхолинэстеразой).
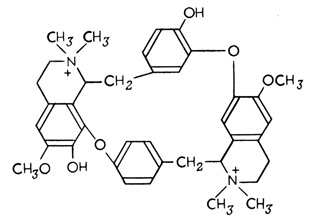
Рис. 72. Структурная формула d-тубокурарина
Недавно было показано, что яды некоторых змей содержат особые нейротоксины, которые связываются практически необратимо и исключительно с холинэргическими рецепторами. К таким токсинам относится α-бунгаротоксин, основной полипептид с молекулярным весом около 8000. Было показано, что в электрогенной ткани меченый α-бунгаротоксин способен связываться с рецепторами мембраны, создавая плотность около 10 000 молекул на 1 мкм2. В нормальной мышце и электрогенной ткани очень мало центров связывания находится вне той области плазматической мембраны, которая участвует в формировании нервно-мышечного соединения. После денервации мышца приобретает способность отвечать на ацетилхолин при нанесении его на любой участок клеточной поверхности. Одновременно и распределение центров связывания бунгаротоксина утрачивает локальный характер.
На необратимости и специфичности связывания таких токсинов основаны попытки идентификации и выделения холинэргических рецепторов. Путем обработки тритоном Х-100 мембран, меченных 131I-токсином, удается выделить комплексы токсина с рецептором (рис. 73). Данные хроматографии и центрифугирования в градиенте плотности позволяют предположить, что молекулярный вес основного компонента рецептора примерно равен 80 000. К сожалению, пока не удалось отделить выделенный рецептор от токсина и изучить его в изолированном виде. По молекулярному весу и плотности распределения на мембране центров связывания для бунгаротоксина можно вычислить, какую долю всего белка постсинаптической мембраны составляет белок рецепторов; доля эта оказалась больше 20%.
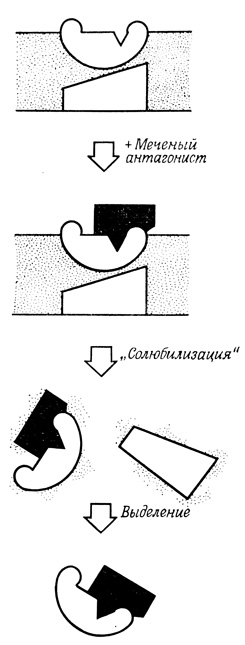
Рис. 73. Выделение комплекса рецептор - антагонист
Центры связывания для ацетилхолина и его антагонистов также удалось выделить из мембран различных клеток (в том числе и нервных) в составе фракции, растворимой в хлороформе. Полученное вещество было идентифицировано как липопротеид (гидрофобный комплекс липида и белка). При добавлении к искусственной фосфолипидной мембране это вещество вызвало появление чувствительной к ацетилхолину ионной проводимости, которая ингибировалась d-тубокурарином.
Оба экспериментальных подхода рассматривают рецептор ацетилхолина и ацетилхолинэстеразу как самостоятельные компоненты. А между тем и в нервно-мышечном соединении и в электрогенной ткани оба эти компонента присутствуют в эквивалентных количествах. Вполне возможно, что в интактной мембране они образуют единый макромолекулярный комплекс.
Многие рецепторы являются в настоящий момент объектом интенсивных исследований. Успехами в этой области мы обязаны главным образом появлению такого метода, как хроматография по сродству, и усовершенствованию методов выделения мембранных белков. С помощью меченого инсулина удалось выделить рецепторы инсулина из печени, жировых клеток и лимфоцитов; эти рецепторы довольно подробно изучены. Рецептор инсулина представляет собой белок (или гликопротеид) с молекулярным весом около 300 000; молекулы имеют палочковидную форму. Он входит в состав плазматической мембраны и поддается "солюбилизации" детергентами. После отщепления фосфолипида и сиаловой кислоты рецептор сохраняет способность связывать инсулин. Хотя инсулин по-разному влияет на метаболизм печени и жировой ткани, значения констант его связывания и количественные характеристики его эффекта для обеих тканей одинаковы. Соответственно рецепторы, выделенные из этих тканей, имеют те же константы связывания инсулина и его производных, что и интактные мембраны.
Очевидно, что рецепторные белки должны иметь по крайней мере два функциональных центра, один из которых служит для связывания агониста или антагониста, а другой трансформирует полученный сигнал в ту форму, которая передается клетке-мишени. Взаимодействие между этими центрами осуществляется благодаря конформационным изменениям в молекуле рецептора, возникающим при связывании с агонистом или его отщеплении.
Дальнейшая передача информации осуществляется различными способами. Процесс передачи нервного импульса и инициации мышечного сокращения осуществляется посредством быстрого изменения электрических параметров клеточной мембраны, которое распространяется по мембране в виде потенциала действия. Чаще же рецептор, находящийся на наружной поверхности клетки, каким-то образом контролирует активность фермента, катализирующего синтез второго посредника.
Судьба первого посредника во многих случаях неясна, хотя известно, что при постоянных физиологических условиях его концентрация в крови остается постоянной, несмотря на продолжающиеся процессы синтеза и секреции. Второй посредник, выполнив в клетке свою миссию, разрушается под действием специфических внутриклеточных ферментов.
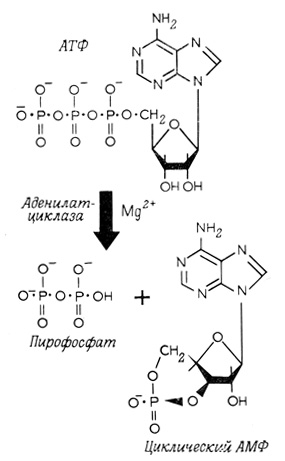
Рис. 74. Синтез циклического АМФ
Необходимыми компонентами системы второго посредника является аденилатциклаза, катализирующая синтез циклического АМФ, а также цАМФ-фосфодиэстераза (рис. 74). В прямых экспериментах на препаратах плазматических мембран, выделенных из различных тканей, показано регулирующее влияние ряда гормонов на активность аденилатциклазы. Одни гормоны ее стимулируют, другие подавляют (рис. 75).
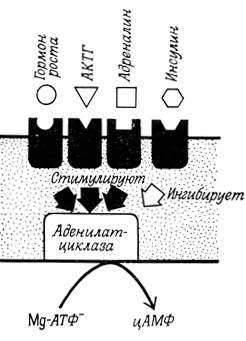
Рис. 75. Влияние различных гормонов на активность аденилатциклазы
Ниже приводится перечень этих гормонов.

Если различные эффекты одного агониста опосредуются разными рецепторами, то каждый из них независимо от другого влияет на активность аденилатциклазы. Взаимодействие адреналина с β-рецепторами стимулирует активность аденилатциклазы, а с α-рецепторами - подавляет ее или вовсе не изменяет. In situ аденилатциклаза способна взаимодействовать одновременно с несколькими различными типами молекул, стимулирующих или ингибирующих функцию рецепторов. Подобная система, которую можно рассматривать как комплекс каталитической субъединицы фермента с одной или несколькими регуляторными субъединицами (рецепторами), проявляет свою активность лишь в соответствующем фосфолипидном окружении. Если фермент теряет свое фосфолипидное окружение, то часть его каталитической активности может сохраниться, однако рецепторная способность полностью утрачивается.
Изменения, вызываемые в клетках гормонами, которые стимулируют активности аденилатциклазы, или поступающими извне аналогами циклического АМФ, весьма разнообразны. Сюда относятся изменения внутриклеточных ферментативных систем (например, системы мобилизации глюкозы из депо гликогена в тканях), а также различные процессы, зависящие от функционального состояния клеточной мембраны, в том числе подвижность клетки и ее структура.
Многие процессы, осуществляемые с помощью рецепторов, протекают без участия циклического АМФ. Таковы некоторые эффекты инсулина и ацетилхолина, действие адреналина на α-рецепторы. Ряд эффектов связан с образованием других вторых посредников. К ним относится циклический гуанозин-3′, 5′-монофосфат (циклический ГМФ) продуцируемый с участием гуанилатциклазы (рис. 76). Концентрация циклического ГМФ в тканях изменяется под действием гормонов и нейромедиаторов, и эти изменения не связаны с колебаниями активности аденилатциклазы. Функционирование рецепторов мембраны обеспечивает высокую эффективность контроля внутриклеточных процессов при участии нескольких независимых вторых посредников.
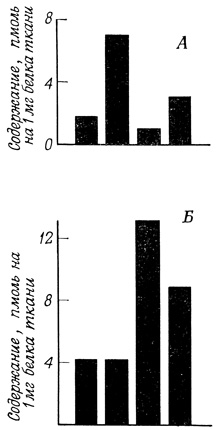
Рис. 76. Участие циклического АМФ (Б) и вторых посредников, например гуанозин-3′, 5′-монофосфата (А), в некоторых процессах, осуществляемых с помощью рецепторов
Еще один способ обмена информацией можно наблюдать у клеток эпителия. На местах соединения этих клеток существуют специализированные комплексы, для которых характерны низкое электрическое сопротивление и высокая проницаемость для некоторых химических компонентов. Мембрана эпителиальной клетки не способна к такому возбуждению, какое наблюдается у мембраны нервных и мышечных клеток. Однако слой эпителиальных клеток ведет себя так, как если бы цитоплазма всех клеток представляла собой единый проводник, окруженный со всех сторон изолятором, функцию которого выполняют те части клеточной поверхности, которые обращены наружу. Участки мембраны, формирующие область контакта между клетками, обладают примерно в 10 000 раз более высокой ионной проводимостью по сравнению с остальной поверхностью клеточной мембраны. Области контактов отличаются также исключительно высокой проницаемостью для более крупных молекул. Это было убедительно показано в опытах с красителями. Например, краситель проционовый желтый с молекулярным весом 500, введенный в клетку эпителия, быстро диффундирует в соседние клетки и почти не попадает во внеклеточное пространство (рис. 77). Высокая проводимость между клетками эпителия регулируется ионами Са2+. Обработка эпителия с помощью ЭДТА (связывает ионы Са2+) или инкубация в среде, не содержащей кальция, приводит к нарушению связи между клетками; добавление ионов Са2+ восстанавливает исходные свойства системы. Отличительной чертой некоторых злокачественных клеток (нередко исходящих из эпителия) является утрата способности к образованию соединительных комплексов, а следовательно, нарушение координации их активности.
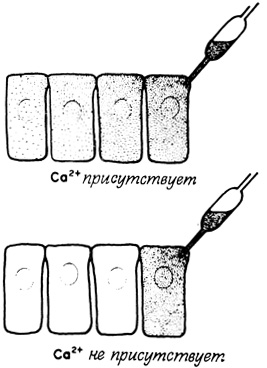
Рис. 77. Регуляция проводимости между клетками с помощью ионов Са2+
Вы одиноки и вам хотелось бы усладиться красивым трахом с чудными индивидуалками? Только приятные проститутки круглосуточно принимают сообщения и будут рады исполнить все ваши влечения в сексе.
|
ПОИСК:
|
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'