
5.2. Компартментализация и регуляция метаболизма
Мембраны обусловливают компартментализацию клетки, отделяя тем самым друг от друга различные процессы метаболизма. Отдельные ферменты могут быть растворимыми, но, заключенные внутри органеллы, они функционируют фактически независимо от цитоплазмы. Другие ферменты могут быть прикреплены к мембране или составлять ее часть. В этом случае их активный центр обращен в один из отсеков, ограниченных мембраной. Физическое разделение метаболических процессов обеспечивается полупроницаемостью липопротеидных мембран - свойством, которое предотвращает свободное движение не только макромолекул, но также и заряженных водорастворимых промежуточных продуктов метаболизма.
Метаболические системы, однако, не полностью изолированы друг от друга. В мембранах, разделяющих клетку на отдельные отсеки, имеются специальные механизмы, обеспечивающие избирательное поступление субстратов, выделение продуктов, а также движение кофакторов и соединений, обладающих регуляторным действием. Следовательно, скорости отдельных метаболических процессов, протекающих внутри отсеков, частично регулируются транспортными системами, расположенными в разделяющих мембранах.
При выделении органелл нарушаются связи со средой, которые регулируют метаболические процессы, и метаболизм таких органелл может измениться. Например, если утрачен некий фактор, обеспечивающий транспорт определенного субстрата, то использование этого субстрата станет невозможным даже при наличии всех необходимых ферментов. Метаболизм восстанавливается, когда, например, в результате осмотического шока нарушается целостность органеллы (гл. 1). Окисление различных добавленных промежуточных продуктов метаболизма во фракции неразрушенных митохондрий протекает с небольшой скоростью. Скорость эта значительно возрастает при повреждении митохондрий. Ниже приведены величины, характеризующие интенсивность поглощения кислорода ннтактными митохондриями и митохондриями, разрушенными ультразвуком, при окислении различных субстратов.

Данные, полученные при изучении явлений, связанных с латентностью, и путей ее преодоления, позволят лучше понять физическую природу мембранных барьеров и выяснить механизмы транспорта отдельных метаболитов через эти барьеры.
Метаболизм в митохондриях летательной мышцы мясной мухи, почти полностью направленный на производство энергии, использует в качестве "топлива" субстраты (пируват и 3-глицерофосфат), для которых имеется специфическая система транспорта через митохондриальную мембрану. Эта мембрана непроницаема для промежуточных продуктов цикла трикарбоновых кислот. В противоположность этому митохондрии печени и почек млекопитающих обладают широким набором транспортных систем, например, для сукцината, малата, α-кетоглутарата, пирувата, глутамата и цитрата. Одни из этих транспортных систем обеспечивают быстрое проникновение "горючего" в митохондрии, другие - обмен специфических промежуточных продуктов цикла трикарбоновых кислот с цитоплазмой. Например, в результате выхода цитрата из митохондрий происходит образование ацетилкофермента А, необходимого для синтеза жирных кислот и стеринов в цитоплазме.
Интактные митохондрии, выделенные из различных тканей, не окисляют добавленный извне НАД⋅Н и не включают 14С-НАД⋅H. В некоторых тканях, однако, цитоплазматический НАД⋅H представляет собой весьма важный источник топлива для митохондриального синтеза АТФ. В этом случае непроницаемый барьер преодолевается с помощью "челночного" механизма передачи восстановительных эквивалентов (рис. 93). Внемитохондриальный НАД⋅H используется внемитохондриальной дегидрогеназой для восстановления соединения, которое затем проникает в митохондрии, где окисляется внутримито-хондриальной дегидрогеназой. Последовательность реакции повторяется после возвращения этого соединения в цитоплазму.
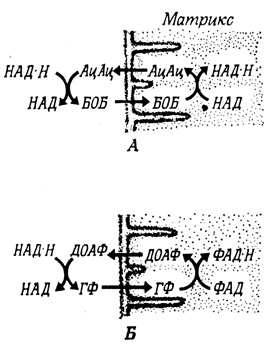
Рис. 93. 'Челночный' механизм передачи восстановительных эквивалентов в митохондриях сердца (А) и летательной мышце насекомых (Б). БОБ - β-оксибутират; АцАц - ацетоацетат; ДОАФ - диоксиацетон- фосфат; ГФ - L-глицерол-З-фосфат
Аналогичная ситуация возникает при окислении жирных кислот (рис. 94). Внемитохондриальный ацил-КоА не проникает в митохондрии, а ацильная группа проходит через внутреннюю мембрану митохондрии, соединяясь с карнитином [(CH3) 3N+-CH2-CHOH-CH2-COOH]. Имеется две ацил-КоА: карнитин - ацилтрансферазы, которые располагаются по обе стороны внутренней мембраны митохондрий. Таким образом, окисление жирных кислот изолированными митохондриями будет протекать эффективно только в присутствии адекватных количеств карнитина. В исключительных случаях, например у мучного хрущака, карнитин может быть весьма важным фактором, регулирующим рост.
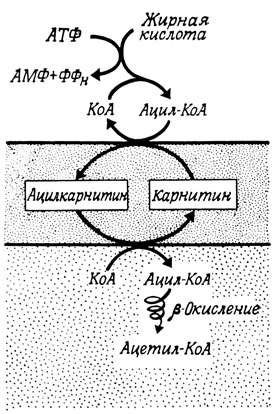
Рис. 94. Окисление жирных кислот изолированными митохондриями при участии карнитина
Для того чтобы транспорт электронов и окислительное фосфорилирование осуществлялись с максимальной скоростью, внутренняя мембрана митохондрий должна постоянно снабжаться АДФ. АДФ образуется в цитоплазме в результате многих метаболических реакций, а его быстрое поступление в митохондрии обеспечивается специальной транспортной системой, идентифицированной в опытах с растительным гликозидом атрактилозидом (рис. 95). Это соединение, не оказывающее непосредственного влияния на механизм окислительного фосфорилирования, ингибирует фосфорилирование АДФ в интактных митохондриях, но не ингибирует эту реакцию в субмитохондриальных частицах, у которых мембрана "вывернута наизнанку".
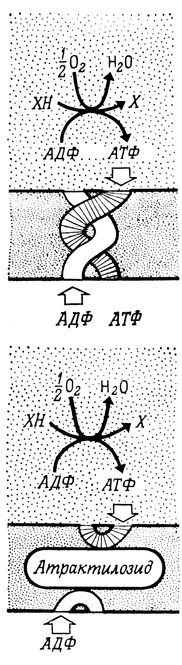
Рис. 95. Транспорт адениннуклеотидов через наружную мембрану митохондрий
Регуляция скоростей метаболических реакций может также осуществляться путем перемещения регулирующих веществ между отсеками клетки. Хорошим примером такого типа регуляции скорости метаболической реакции служат процессы, протекающие в актомиозиновой системе скелетной мышцы. Эта система гидролизует АТФ, и мышца сокращается в том случае, когда концентрация Са2+ в цитоплазме превышает 10-6 М (рис. 96, Б). При понижении концентрации Са2+ АТФазная активность падает, и мышца расслабляется (рис. 96, А).
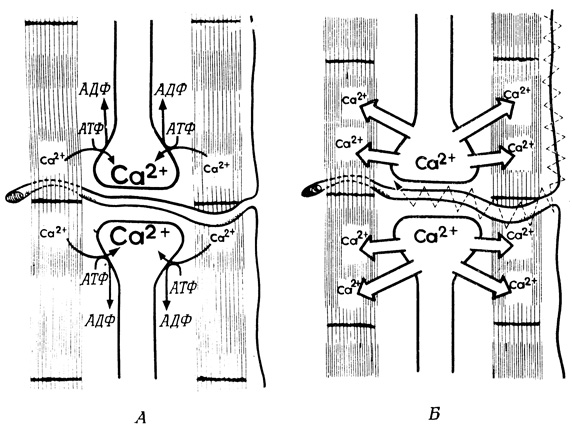
Рис. 96. Активный транспорт ионов Са2+ в актомиозиновой системе скелетной мышцы. Объяснения см. в тексте
Концентрации ионов Са2+ в цитоплазме мышечных клеток регулируются работой саркоплазматической сети, которая обладает мощной системой активного транспорта кальция. В результате кальций накапливается внутри сети, а его концентрация в цитоплазме значительно понижается (<10-7 М); при такой концентрации мышца находится в расслабленном состоянии. Высвобождение накопленного кальция в цитоплазму обусловлено быстрым увеличением проницаемости мембран саркоплазматической сети для ионов Са2+. Это изменение проницаемости мембраны вызывается потенциалом действия, который генерируется на двигательных концевых пластинках и распространяется по цилиндрическим впячиваниям сарколеммы.
Характерной чертой компартментализации метаболизма часто является разделение противоположно направленных процессов. В результате каждый из этих процессов регулируется независимо один от другого. Например, синтез жирных кислот происходит в цитоплазме, а β-окисление жирных кислот - в митохондриях. Сходным образом биосинтез белка протекает в цитоплазме, тогда как его деградация осуществляется в лизосомах.
Обычно мембрана лизосом с высокой эффективностью предотвращает высвобождение потенциально опасного арсенала лизосомных ферментов в цитоплазму; на мембрану лизосом эти ферменты не действуют. В нормальных условиях контакт субстратов лизосомных ферментов с самими ферментами происходит в результате образования вторичных лизосом. Материалы внеклеточной среды адсорбируются на плазматической мембране, которая затем, впячиваясь, образует пузырьки. Эти пузырьки мигрируют в цитоплазму, где сливаются с первичными лизосомами, продуцируемыми системой Гольджи (гл. 4). Образующиеся структуры получили название вторичных лизосом.
Иногда отдельные участки цитоплазмы, содержащие митохондрии и другие органеллы, оказываются внутри крупных мембранных образований (вакуолей). Происхождение мембран этих вакуолей остается неясным. Такие вакуоли, называемые аутофагирующими (рис. 97), содержат лизосомные гидролазы и поэтому эквивалентны в некоторой степени вторичным лизосомам. Возникновение аутофагии связано часто с изменением характера метаболизма (например, при процессах инволюции ткани) или с длительным голоданием (когда некоторые части клетки разрушаются для того, чтобы поддержать метаболизм).
Рис. 97. Аутофагирующая вакуоль в клетке
В результате ферментативного гидролиза содержимого вторичных лизосом образуются низкомолекулярные водорастворимые продукты (сахара, жирные кислоты, аминокислоты и т. д.), которые затем попадают в цитоплазму (рис. 98). Этот внутриклеточный переваривающий аппарат используется как для переваривания захваченной пищи или внутриклеточных материалов, так и для разрушения вредных продуктов, попадающих в клетку извне, например чужеродных белков, бактерий и вирусов.
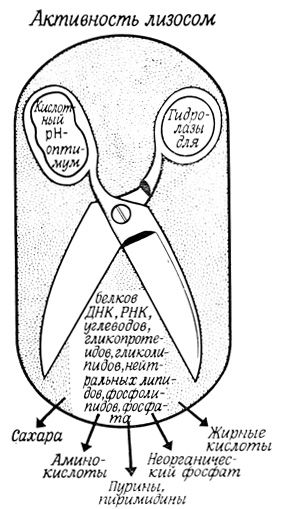
Рис. 98. Схема активности лизосом
В нормальных условиях лизосома способна осуществить полную деградацию захваченных макромолекул. Однако если в клетку попадают неперевариваемые материалы (минеральные вещества, металлы в коллоидном состоянии и т. д.), то они накапливаются в специальных пузырьках, получивших название остаточных телец. Ошибки генетического кодирования, в результате которых в клетке не синтезируется один из нормальных лизосомных ферментов, приводят к тому, что клетка начинает наполняться остаточными тельцами, содержащими неперевариваемый эндогенный материал, и возникают так называемые болезни депонирования, связанные, например, с накоплением гликогена или гликолипидов в клетках.
Иногда неперевариваемые частицы нарушают структуру мембраны лизосом, и тогда лизосомные ферменты вытекают в цитоплазму. Например, частицы асбеста или кремнезема вызывают подобные нарушения в лейкоцитах и макрофагах легких при асбестозе и силикозе, а кристаллы мочевой кислоты - в макрофагах тканей суставов при подагре. Последствия для пораженных клеток, а в некоторых случаях и для окружающих их тканей могут быть самыми серьезными: воспаление, некроз и гибель. К аналогичным последствиям могут привести повреждения лизосомных мембран мощными окислителями (например, светочувствительными красителями и четыреххлористым углеродом), веществами, нарушающими фосфолипидные структуры (например, витамин А и лизолецитин), а также в результате некоторых реакций антигенов с антителами (при ревматоидном артрите).
Цитоплазматические ферменты остаются в клетке благодаря плазматической мембране. Однако эта мембрана также может получить повреждения при воздействии описанных выше агентов, а также вследствие дефицита метаболической энергии, возникающего часто при аноксии, связанной с нарушением притока крови к клеткам, или при инфекции. Во всех этих случаях ферменты вытекают во внеклеточную среду, а оттуда поступают в кровь. При небольших повреждениях возможно восстановление клеточной мембраны, однако серьезные нарушения в структуре приводят к гибели клеток и к массированному высвобождению цитоплазматических ферментов, а также ферментов из внутриклеточных органелл. В клинике изучение уровня, характера и кинетики активности внутриклеточных ферментов в крови играет весьма важную роль при определении локализации, течения и тяжести патологического процесса.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'