
5.3. Значение ассоциации ферментов с мембранами
Скорость реакций, катализируемых ферментами, зависит от концентрации фермента, субстрата (или субстратов) и необходимых кофакторов. Высокие скорости ферментативных реакций в клетке достигаются часто благодаря тому, что ферменты (растворимые или связанные с мембранами), субстраты и кофакторы находятся в одном и том же отсеке клетки. В этом случае высокая концентрация метаболитов поддерживается в каком-то определенном участке, а не во всей клетке.
Если продукт одной ферментативной реакции является одновременно субстратом другой реакции, то присоединение обоих ферментов к одной и той же мембране можно рассматривать как способ, позволяющий уменьшить среднее расстояние между этими ферментами. В качестве примера приведем два взаимосвязанных ферментативных процесса, осуществляемых сахаразой (гидролизующей сахарозу до глюкозы и фруктозы) и транспортной системой для глюкозы (рис. 99). Обе ферментативные системы локализованы на щеточной каемке эпителия кишечника. Когда сахароза и свободная глюкоза содержатся в кишечнике в эквимолярных концентрациях, глюкоза, образующаяся из сахарозы, транспортируется в клетки быстрее, чем свободная глюкоза. Блокирование транспортной системы глюкозы флоридзином не оказывает влияния на гидролиз сахарозы; этот результат свидетельствует о том, что сахараза сама по себе не является транспортной системой глюкозы. Следовательно, глюкоза, образующаяся в результате гидролиза сахарозы, должна либо присутствовать в высоких концентрациях поблизости от транспортной системы, либо направляться непосредственно в транспортную систему из активного центра сахаразы. Такие "кинетические преимущества" не распространяются на глюкозу, образовавшуюся при гидролизе глюкозо-1-фосфата щелочной фосфатазой - другим ферментом, присутствующим в щеточной каемке клеток кишечного эпителия. Это обстоятельство также подтверждает наличие специфических пространственных взаимоотношений между сахаразой и транспортной системой глюкозы.
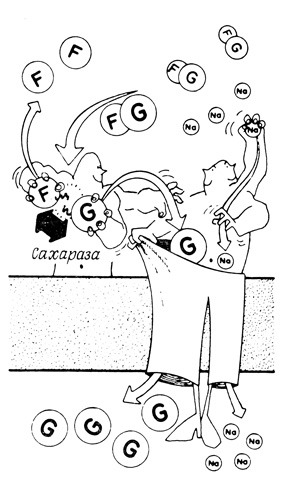
Рис. 99. Гидролиз сахарозы и транспортная система для глюкозы
Если несколько ферментов катализируют цепь реакций, в которой продукт первой реакции служит субстратом для второй и т. д., то говорят, что эти ферменты образуют мультиферментную систему. Многочисленные мультиферментные системы обнаружены в мембранах. К ним относятся различные системы транспорта электронов (цепь дыхательных ферментов, цепь ферментов, осуществляющих перенос электронов при фотосинтезе, микросомная оксидаза со смешанными функциями, ксантиноксидаза, дегидрогеназа дигидрооротовой кислоты), а также мультиферментные комплексы, принимающие участие в биосинтезе некоторых липидов (холестерина, фосфолипидов, глицеридов). Количество отдельных ферментов в составе некоторых связанных с мембраной систем определяется простыми молярными отношениями. Даже в тех случаях, когда дискретные (в физическом смысле) мультиферментные комплексы не удается выделить in si tu, оказывается возможным определить их минимальный молекулярный вес, используя данные по молекулярному весу индивидуальных компонентов, а также данные по молярным отношениям этих компонентов в составе комплекса. Из обработанных детергентом фрагментов внутренней мембраны митохондрий можно выделить комплексы, осуществляющие транспорт электронов (комплексы I-IV). Выделенные комплексы полностью сохраняют свои транспортные функции и характеризуются определенным хорошо воспроизводимым составом. По-видимому, эти комплексы представляют собой части одной строго организованной мультиферментной системы, локализованной в мембранах (рис. 100).
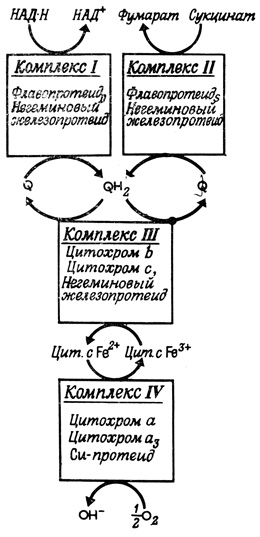
Рис. 100. Комплексы, осуществляющие транспорт электронов
Пространственная близость соседних компонентов мультиферментных систем имеет особое значение в тех случаях, когда в ферментных реакциях образуются нестабильные промежуточные продукты. В этих случаях благодаря локализации на мембране расстояние, которое проходят реагирующие молекулы в процессе диффузии, сводится до минимума. Тем самым обеспечивается перенос энергии, как, например, при фотосинтезе, только между теми двумя реакционными центрами, которые расположены на исключительно малом расстоянии друг от друга. Исследования, проведенные с помощью спектроскопических методов, показали, что в процессе транспорта электронов по дыхательной цепи митохондрий образуются свободные радикалы, такие, как семихиноны, которые в свободном растворе существуют очень недолго (рис. 101).
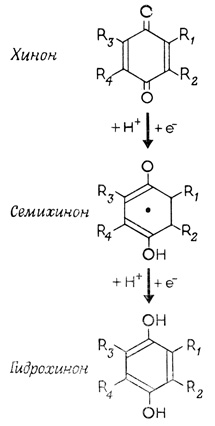
Рис. 101. Образование свободных радикалов в процессе транспорта электронов по дыхательной цепи митохондрий
Последовательность компонентов в дыхательной цепи митохондрий была установлена при помощи сложнейших спектральных методик с использованием окислительно-восстановительных красителей и ингибиторов, реагирующих с отдельными частями системы. Некоторые компоненты были получены в очищенном виде (однако часто свойства их были изменены), тогда как другие охарактеризованы только в составе мембран. Например, цитохромоксидаза содержит два отличающихся по спектру компонента, обозначаемых как цитохромы а и а3. Несмотря на то что цитохромы а и а3 по-разному реагируют на ингибиторы, такие, как цианид и окись углерода, все попытки выделить их раздельно в очищенном состоянии оказались безуспешными.
Полная дыхательная цепь состоит из ряда компонентов, окислительно - восстановительный потенциал которых последовательно понижается. Источником электронов служит НАД⋅Н (стандартный окислительно - восстановительный потенциал - 0,32 В) и несколько других субстратов (сукцинат, глицерол-3-фосфат, КоА-производное жирной кислоты), которые характеризуются более низким окислительно - восстановительным потенциалом. Первоначально электроны транспортируются к флавопротеидам, а затем переносятся другими компонентами мультиферментного комплекса (хиноны, цитохромы и, вероятно, негеминовые железосодержащие белки) по дыхательной цепи до тех пор, пока с восстановлением кислорода потенциал не достигнет величины, равной +0,82 В (рис. 102).
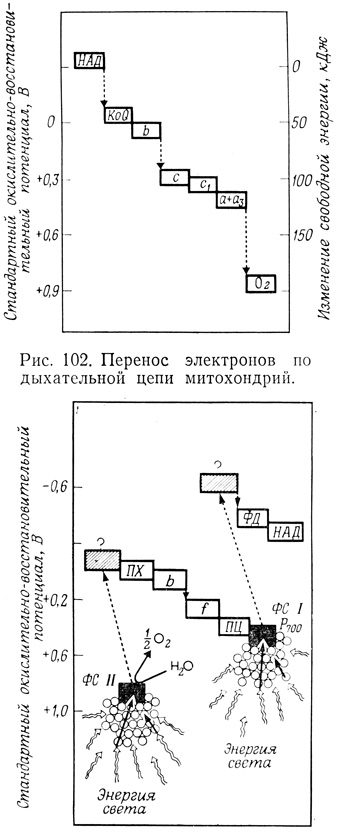
Рис. 102. Перенос электронов по дыхательной цепи митохондрий. Рис. 103. Перенос энергии в процессе фотосинтеза. ПХ - пластохинон; b - цитохром b559; ФД - ферредоксин; f - цитохром f; ПЦ - пластоцианин; ФСI и ФСII - фотосистемы I и II
Изменение потенциала в этой системе сопровождается уменьшением свободной энергии. Так, при переносе электронов от НАД⋅Н (n=2) к кислороду общее изменение потенциала составляет [+0,82-(-0,32)]=1,14 В, что соответствует изменению свободной энергии приблизительно на 220 кДж. Этого изменения свободной энергии более чем достаточно для того, чтобы обеспечить образование 3 молекул АТФ из АДФ (3×31 кДж) в сопряженных процессах окислительного фосфорилирования. Если связь между транспортом электронов и окислительным фосфорилированием нарушена, т. е. эти процессы разобщены, то высвобождающаяся энергия рассеивается в виде тепла.
В фотосинтетических процессах (рис. 103) свет возбуждает ряд липоидных пигментов (каротиноиды, фикобилины и хлорофиллы а и b), содержащихся в мембранах хлоропластов. Эти пигменты передают свою энергию возбуждения (экситоны) с помощью резонансного механизма миграции энергии специальной форме хлорофилла а (такая система получила название фотосистемы II). Электроны этой формы хлорофилла а переходят на более высокий энергетический уровень (более отрицательный потенциал) и восстанавливают пока еще не идентифицированное соединение (предположительно хинон). Электронная дырка в молекуле хлорофилла а заполняется за счет электронов воды, которая при этом расщепляется с выделением протона и кислорода. Затем электроны последовательно переходят от одного компонента транспортной цепи к другому в сторону более высокого положительного потенциала (эта последовательность компонентов включает пластохинон, цитохром b559, цитохром f и пластоцианин). Сопровождающее этот процесс переноса электронов изменение потенциала обеспечивает образование АТФ в сопряженных процессах фотофосфорилирования. В качестве последнего окислительно-восстановительного компонента этой цепи выступает специализированная форма хлорофилла а, свойства которого в значительной степени определяются специфическим мембранным окружением. Эта форма хлорофилла получила название пигмента Р700. Он входит в состав другой функциональной системы, названной фотосистемой I, содержащей другие молекулы хлорофилла а и каротиноиды. Фотосистема I использует свет с большей длиной волны, чем фотосистема II. Энергия возбужденных пигментов передается с помощью резонансного механизма миграции энергии к Р700. Здесь они переходят на более высокий энергетический уровень, соответствующий большему отрицательному потенциалу, затем на акцептор неизвестной природы и в конце концов через негеминовый железосодержащий белок (ферредоксин) транспортируются к НАДФ.
Химические и спектральные исследования показали, что каждая фотосистема содержит сотни молекул хлорофилла и различных пигментов. Обе фотосистемы вместе с соответствующими компонентами переноса электронов и липидами образуют функциональную единицу, получившую название квантосомы. Квантосомы могут существовать в виде дискретных групп с общим молекулярным весом около 2⋅106. Минимальный молекулярный вес митохондриального "дыхательного ансамбля" составляет величину того же порядка.
Белковые компоненты "дыхательного ансамбля" и "квантосомы" прочно связаны с мембранами. Отделить эти компоненты от мембраны чрезвычайно трудно, причем свойства их после выделения и очистки могут существенно измениться. В мембранах белковые компоненты реагируют с низкомолекулярными соединениями, осуществляющими транспорт электронов, и с фотосинтетическими пигментами. В молекулах этих низкомолекулярных соединений можно выделить два структурных фрагмента - реакционный центр и гидрофобный участок, который прочно связывает молекулу с липидами мембраны (рис. 104).
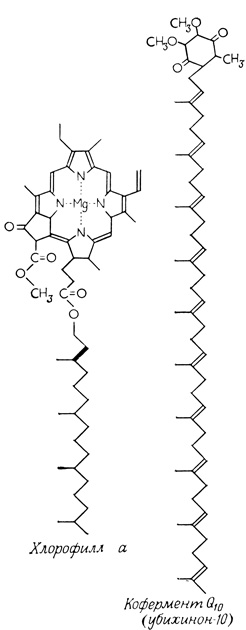
Рис. 104. Низкомолекулярные компоненты дыхательного ансамбля (убихинон-10) и квантосомы (хлорофилл а), в которых отчетливо выделяются два структурных фрагмента
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'