
6.1. Белковые компоненты
Содержание белка в мембранных препаратах, как правило, выше содержания в них липидов. Однако в миелиновой оболочке нервных волокон белок составляет всего 20% общей массы мембраны; это, по-видимому, связано с исключительно низкой метаболической активностью миелина. Точность определения содержания белка в мембранных препаратах в значительной мере зависит от метода выделения. Например, свойства мембран эритроцитов изучались с применением самых различных методов. В зависимости от цели, которую ставили перед собой исследователи, они изучали эти мембраны на физиологическом, химическом или физическом уровне; соответственно различались и условия выделения мембранных препаратов. В результате были получены весьма разнообразные величины.
Различия в белковом составе мембранных препаратов при получении их разными методами легко объяснить присутствием в мембранах белков, слабо связанных с мембранными структурами и легко отщепляющихся даже при довольно мягких воздействиях, таких, как изменения pH или ионной силы. Такие белки принято называть "внешними", и к ним относится ряд белковых веществ, которые вполне можно было бы отнести к белкам водной фазы.
Вместе с тем в состав мембран входят белки, отделение которых возможно лишь при разрушении мембранных структур с помощью органических растворителей, детергентов или протеолитических ферментов. Эти белки, прочно связанные с мембранными структурами, получили название "внутренних". Аминокислотный анализ показал, что такие внутренние белки содержат значительно больше неполярных остатков по сравнению с внешними и немембранными белками. У тех внутренних белков,
для которых установлены аминокислотные последовательности, например цитохром b5 и цитохром - b5-редуктаза эндоплазматической сети, некоторые бактериальные АТФазы и основной гликопротеид эритроцитарной мембраны, были обнаружены полипептидные фрагменты с преобладанием неполярных аминокислотных остатков. В некоторых случаях такие неполярные полипептидные фрагменты оставались в составе мембраны даже после обработки препарата протеолитическими ферментами, например трипсином.
Основной гликопротеид эритроцитарной мембраны (гликофорин) изучен довольно подробно. Его единственная полипептидная цепь состоит из отдельных характерных участков (рис. 109). N-концевой участок несет несколько антигенных олигосахаридных групп находящихся на наружной поверхности клеточной мембраны*. Центральный участок (примерно 35 остатков) состоит целиком из неполярных аминокислотных остатков и как бы "прошивает" мембрану насквозь; более полярный С-концевой участок доступен для введения химической метки со стороны внутренней поверхности мембраны. Сказанное, вероятно, относится и к некоторым другим внутренним белкам. Подобное предположение основано на результатах опытов с введением метки в белковые молекулы и с ферментативным расщеплением мембранных белков, а также на данных, касающихся пространственных взаимоотношений при процессах активации и торможения.
* (Олигосахаридные цепи гликофорина составляют основу некоторых из группоспецифических веществ крови и обладают свойствами рецепторов для агглютининов и для вируса гриппа. Используя рецепторные свойства гликофорина, удалось показать, что его молекулы распределены равномерно по всей поверхности эритроцита. - Прим. ред.)
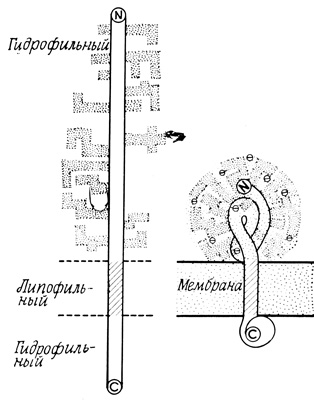
Рис. 109. Основной гликопротеид эритроцитарной мембраны - гликофорин
Исключительно высокое содержание неполярных аминокислотных остатков обнаружено у фермента, выделенного из Staphylococcus aureus. Этот фермент, катализирующий фосфорилирование гидрофобного С55-изопреноидного спирта, отличается хорошей растворимостью в органических растворителях и плохо растворяется в воде; таким образом, весьма вероятно, что молекула фермента целиком находится в неполярной области мембраны.
Исследование различных мембранных препаратов с помощью оптических методов (круговой дихроизм и дисперсия оптического вращения) свидетельствует о высоком содержании участков, имеющих структуру а-спирали, и участков с конформацией статистического клубка. Эти данные хорошо согласуются с предположением о том, что мембранные белки представлены преимущественно глобулярными, а не плоскими протяженными структурами.
Подобная классификация мембранных белков по составу, физическим параметрам и функциональным признакам наталкивается на ряд трудностей, обусловленных разнообразием компонентов, входящих в состав мембран, и сложностью их структуры. Эти же обстоятельства ограничивают и возможности сравнительного изучения белковых компонентов различных мембран, а также попытки обобщения, касающиеся свойств белков определенного типа. Однако вполне подходящей основой для сравнения и обобщения экспериментальных данных по различным мембранным белкам может служить электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (ДДС). При использовании систем, содержащих ДДС, мочевину и меркаптоэтанол, мембранные белки диссоциируют на составляющие их полипептидные цепи, принимают форму жестких палочек и приобретают оболочку из молекул ДДС. Образовавшиеся отрицательно заряженные комплексы удается расфракционировать по размеру с помощью электрофореза в полиакриламидном геле (рис. 110). Это позволяет получить характерную для данного препарата картину полипептидного состава, которая может быть использована в качестве основы для последующих экспериментов. Например, в белковые молекулы, локализованные на поверхности интактных мембран, можно ввести какую-нибудь метку или обработать их ферментами, а затем идентифицировать с помощью ДДС-гель-электрофореза.
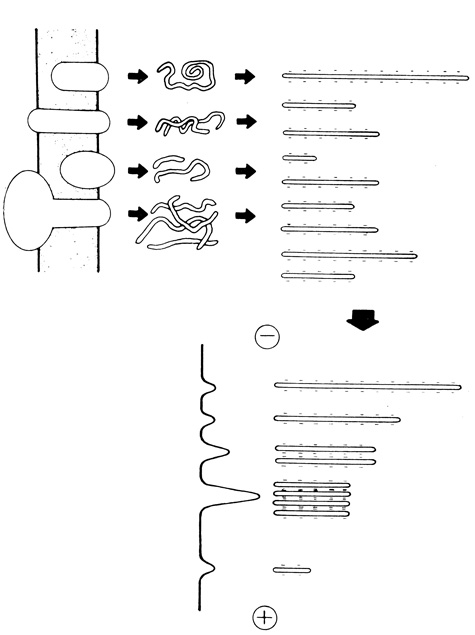
Рис. 110. Диссоциация мембранных белков на составляющие их полипептидные цепи и последующее фракционирование с помощью электрофореза в полиакриламидном геле
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'