
6.6. Механизм обновления
Для того чтобы выяснить механизм обновления компонентов клеточных мембран или изменения их состава, необходимо прежде всего ответить на вопросы о том, как синтезируются необходимые для этого молекулы и как они транспортируются к месту назначения. Синтезированные молекулы должны затем внедриться именно в ту мембрану, для которой они предназначены, и принять участие в организации ее структуры. Позднее эти молекулы должны быть удалены из мембран и подвергнуты деградации. Как внедрение в мембраны, так и их последующее удаление должно осуществляться без нарушения общей структуры мембраны. Некоторые молекулы синтезируются в виде предшественников, которые могут выполнять свои функции только после соответствующей химической модификации. Все эти процессы регулируются системами, способными изменять скорость биосинтеза и (или) деградации каждого типа молекул.
Биосинтез большей части растворимых белков в клетках эукариотов осуществляется на рибосомах, свободно плавающих в цитоплазме, тогда как белки, предназначенные для секреции, синтезируются на рибосомах, связанных с мембраной эндоплазматической сети. До сих пор неизвестно, в какой из рибосомных систем синтезируются мембранные белки: в обоих случаях возникают определенные трудности при объяснении механизма включения синтезированных белков в мембраны. При изучении биосинтеза белка в клетках Escherichia coli, где нет видимых морфологических различий рибосом, удалось тем не менее получить данные, свидетельствующие о наличии нескольких функционально различимых популяций рибосом, ответственных за синтез различных мембранных белков. Эти данные не вызывают удивления, если учесть асимметричное расположение индивидуальных белков в мембранах. Некоторые полипептиды, входящие в состав внутренней мембраны митохондрий и хлоропластов, синтезируются на рибосомах, которые находятся внутри этих органелл.
Фосфолипиды и стерины мембран синтезируются в основном ферментными системами, локализованными в эндоплазматической сети (рис. 124), но, как мы увидим далее, некоторые части фосфолипидных молекул могут затем модифицироваться или замещаться и в других частях клетки. И здесь опять митохондрии и хлоропласты, мембраны которых содержат характерные липиды, представляют собой исключение из общего правила: дифосфатидилглицерин синтезируется на внутренней мембране митохондрий, а хлоропласты, вероятно, синтезируют высоконенасыщенный дигалактозилдиглицерид.
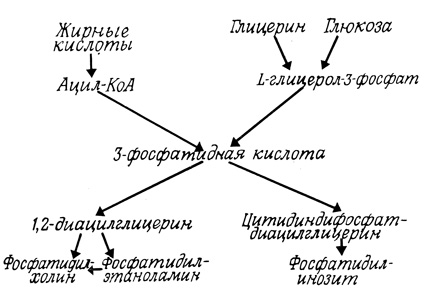
Рис. 124. Биосинтез фосфолипидов
Большая часть белковых и липидных молекул в клетке синтезируется не там, где предполагается их использование. Механизмы, посредством которых белки транспортируются к соответствующим мембранам и включаются в их состав, должны отличаться высокой избирательностью. Все мембранные белки (за исключением белков мембраны эндоплазматической сети) транспортируются к местам сборки мембран, тем не менее механизм этого процесса остается до настоящего времени неизвестным.
Время распределения новообразованных фосфолипидов между различными мембранами клетки варьирует от нескольких минут (фосфатидилинозит) до нескольких часов (фосфатидилхолин и фосфатидилэтаноламин). По-видимому, на скорость этого процесса влияют белки цитоплазмы, которые осуществляют перенос интактных фосфолипидных молекул между мембранами (рис. 125). Фракции растворимых белков, выделенные из некоторых тканей, ускоряют обмен фосфолипидных молекул между липопротеидами (субклеточные фракции или растворимые липопротеиды) или липидами (липосомы или монослои), причем относительные скорости транспорта различных фосфолипидов определяются свойствами ткани, из которой были выделены растворимые белковые фракции. Один из таких растворимых белков, осуществляющих функции переносчиков фосфолипидов, был выделен и очищен. Этот белок с молекулярным весом около 20 000 способен переносить только фосфатидилхолин, причем молярное отношение белка и фосфолипида в образующемся комплексе составляло 1:1. Представляется весьма вероятным, что существуют и другие белки-переносчики, специфичные для различных фосфолипидов, холестерина и жирных кислот с длинной углеводородной цепью*.
* (Недавно из мозга крупного рогатого скота выделен специфический фосфатидилинозитпереносящий белок. - Прим. ред.)
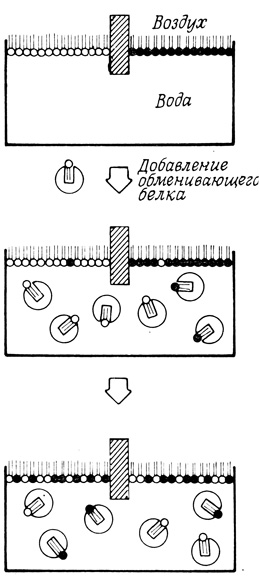
Рис. 125. Участие белковых молекул в процессе распределения липидов между мембранами. Черными кружками обозначены радиоактивные фосфолипиды, белыми - немеченые фосфолипиды
Каков механизм, позволяющий с высокой скоростью и специфичностью направлять липиды в различные мембраны клетки, и как поддерживается различие в липидном составе между этими мембранами? Предполагается, что столь высокая избирательность обусловлена белками, специфичными для каждого типа мембран.
Факторы, определяющие включение новых материалов в мембраны и их объединение с другими компонентами надмолекулярных мембранных структур, изучали с применением как прямых, так и косвенных методов. В прямых экспериментах пытались выяснить, каким образом регулируется включение индивидуальных липидов и белков в мембраны (в модельных системах или в клетках). Косвенные подходы основывались на экспериментах, в которых изучались более сложные факторы, определяющие самосборку и организацию мембранных структур.
Как правило, даже на самой ранней стадии процесса внедряющиеся в мембрану компоненты уже распределены равномерно. Это предполагает некий случайный порядок добавления новообразованных компонентов к уже существующей мембране, хотя не исключено, что их внедрение в мембрану происходит через определенные "точки роста" с последующей латеральной диффузией. По-видимому, все мембраны образуются путем такого расширения предшествующих липопротеидных структур.
Хорошо известно, что деградация большей части клеточных компонентов, осуществляющаяся в процессе обновления, происходит под действием лизосомных ферментов. Это совершенно очевидно, по крайней мере в тех случаях, когда речь идет о полной деструкции клеточных органелл (гл. 5). Менее ясно, принимают ли эти ферменты участие в асинхронном и регулируемом обновлении индивидуальных клеточных белков; в частности, до сих пор неизвестен ни механизм отбора и транспорта индивидуальных молекул в лизосомы, ни механизм их деградации в каких-либо других частях клетки.
В ряде случаев синтезированные в клетках молекулы должны претерпевать определенные изменения, прежде чем они приобретут свойства, соответствующие их роли в мембране. Эти изменения происходят либо на пути к мембране, либо после прибытия к месту назначения. Модификация липидов состоит в перестройке последовательности жирных кислот путем отщепления одних и замещения других остатков жирных кислот. В состав многих мембран входят фосфолипазы A1 и A2, которые отщепляют ацильные группы, занимающие положения 1 и 2 в молекуле глицерофосфолипида, а также ацилтрансферазы, присоединяющие ацильные группы к соответствующим лизофосфолипидам. Эти процессы играют важную роль в метаболизме липидов. Так, например, в печени меченный 32P фосфатидилинозит содержит первоначально одну двойную связь на молекулу. В результате определенных превращений первичного фосфатидилинозита в клетке образуется 1-стеароил, 2-арахидоноильное производное с четырьмя двойными связями. Этот последний тип фосфолипидных молекул получил широкое распространение в тканях животных. К модификациям другого типа относятся метилирование фосфатидилэтаноламина с образованием фосфатидилхолина и (у бактерий) превращение фосфатидилсерина в фосфатидилэтаноламин, а также аминоацилирование фосфатидилглицерина.
Некоторые белки тоже модифицируются после синтеза. Гем цитохрома b5, одного из компонентов цепи транспорта электронов, локализованной в мембране эндоплазматической сети, присоединяется к апоферменту только после того, как последний внедрится в мембрану. Образование гликопротеидных молекул, располагающихся впоследствии на клеточной поверхности, начинается в эндоплазматической сети, где к полипептидной цепи присоединяются боковые олигосахаридные остатки. Этот процесс продолжается в комплексе Гольджи и завершается только по прибытии гликопротеида к плазматической мембране. Синтез молекул гликопротеида в клетке осуществляется непрерывно, и соответственно постоянно происходит удаление старых молекул с клеточной поверхности.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'