
Морфофункциональная организация межклеточных контактов (Черненко Ю. П.)
В различных тканях каждая клетка связана участками своей плазмолеммы с соседними с помощью МК, которые состоят из ряда элементов, получивших название клеточных соединений (cell junctions). С развитием электронной микроскопии МК стали самостоятельными объектами исследования. Мы ограничимся рассмотрением клеточных соединений между соматическими клетками. Описание структуры и функции соединений между нервными клетками - химических синапсов, а также нервномышечных соединений является, на наш взгляд, самостоятельной задачей. Этому вопросу посвящен ряд обзоров и монографий (Н. Н. Боголепов, 1975; А. А. Манина, 1978; Дж. Экклс, 1966; А. Питере и др., 1972; Barondes S. Н., 1976).
Для исследования структуры клеточных соединений применяют различные методы: биохимические (выделение отдельных соединений с помощью ультрацентрифугирования с целью изучения их молекулярной структуры и ультраструктуры), физические (рентгеноструктурный анализ), биофизические (исследование проницаемости МК и клеточных соединений для ионов и молекул, определение величины адгезивной прочности контактов), морфологические (электронная микроскопия, исследование ультратонких сечений клеточных соединений), цитохимические и радиоавтографические, морфометрический анализ, получение объемных изображений клеточных соединений, исследование контактных поверхностей клеток и поверхностей клеточных пластов.
Большую информацию о внутренней структуре мембран клеточных соединений дает метод замораживания - раскалывания (разламывания). При раскалывании быстрозамороженных тканевых кусочков линия расхода проходит через клеточные мембраны по их гидрофобной зоне. При этом образуются две новые поверхности: Р - поверхность (protoplasmic face) - наружная поверхность внутреннего листка и Е - поверхность (extracellular face) - внутренняя поверхность наружного листка мембраны (D. Branton и др., 1975). Исследование криофрактограмм мембран клеточных соединений позволило установить, что на Р - и Е - поверхностях располагаются гладкие области (рис. 1, 2), фосфолипидные поля и частицы, представляющие собой глобулярные интегральные белки или липопротеиды (L. A. Staehelin, 1974; L. Orci и др., 1977).
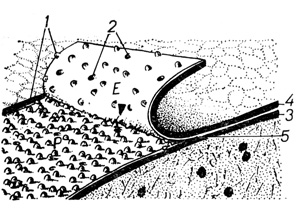
Рис. 1. Схема раскалывания плазмолеммы и образования двух новых поверхностей при использовании метода замораживания - разламывания: Р - наружная поверхность цитоплазматического листка (3), Е - внутренняя поверхность наружного листка мембраны (4), 1 - внутримембранные частицы, 2 - углубления, соответствующие месту расположения частиц на комплементарной поверхности, 5 - гидрофобная область мембраны
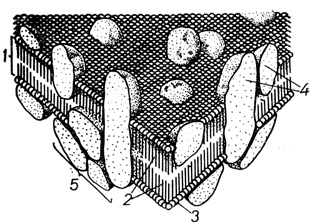
Рис. 2. Жидкостно-мозаичная модель строения клеточной мембраны: 1 - липидный матрикс, 2 - гидрофобные области липидных молекул, 3 - полярные области липидных молекул, 4 - глобулярные интегральные белки, погруженные в липидный матрикс, 5 - поверхностные белки по S. J. Singer, G. L. Nicolson (1972)
Все клеточные соединения, обнаруженные в тканях животных, можно разделить по их функциональной роли на четыре группы: обеспечивающие барьерную функцию - изолирующие, межклеточную коммуникацию, или метаболическую связь между клетками - коммуникативные, межклеточный транспорт веществ- транспортные, адгезивную связь между клетками - адгезивные.
Терминология клеточных соединений основана на их морфологических и функциональных особенностях. Выделяют пять основных типов клеточных соединений, а именно: соединения простые, плотные, слипания, или десмосомы, щелевые и септированные, или септосодержащие. Рассмотрим особенности ультра-структуры и функции каждого из типов соединений.
Простое соединение (junctio cellularum simplex, simple junction) обычно называют недифференцированной или неспециализированной областью МК- Оно занимает в МК наибольшую по сравнению с другими клеточными соединениями площадь. Плазмолеммы, образующие простое соединение, разделены пространством шириной 15-25 нм (рис. 3). Это межмембранное пространство заполнено бесструктурным содержимым с низкой электронной плотностью. Мембраны простого соединения расположены комплементарно, контур одной из них точно повторяет контур другой, что, очевидно, отражает согласованное движение плазмолемм. В разных тканях в простых соединениях можно встретить участки расширения межмембранных пространств до 50 нм, протяженностью до 0,5 мкм. В контакте гепатоцитов эти полости заполнены крупнодисперсным содержимым и отражают, вероятно, процессы транспорта веществ вдоль МК (рис. 4). Мембраны простых соединений гепатоцитов часто образуют пиноцитозные пузырьки (рис. 5). На сколах плазмолемм в области простого соединения на Р- и Е - поверхностях обнаружены редко расположенные глобулярные частицы диаметром 4-16 нм. Их количество на Р - поверхности больше, чем на Е - поверхности. Внутримембранные частицы соответствуют интегральным глобулярным белкам, погруженным в липидный матрикс мембран. Предполагают, что внутри частиц проходит гидрофильный канал, соединяющий внутреннюю и внешнюю стороны мембраны (L. Orci и др., 1977).
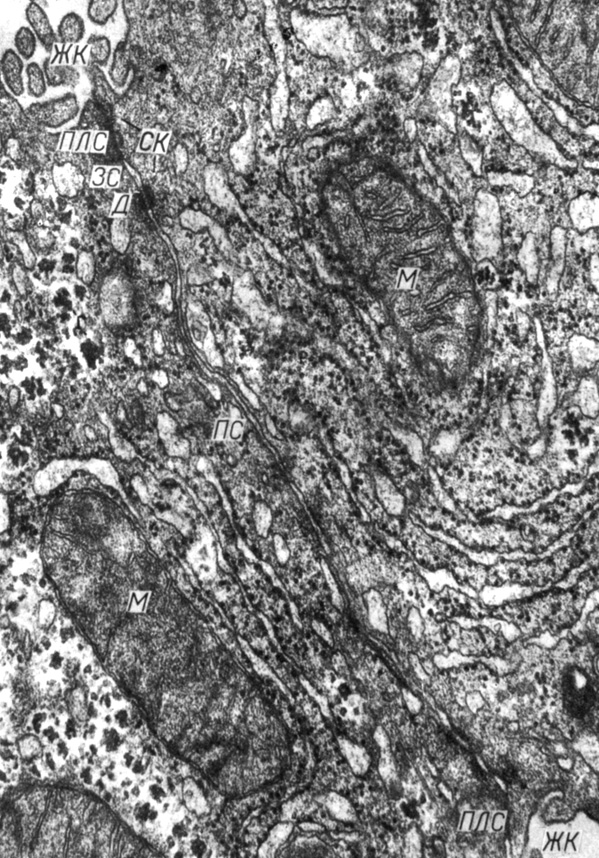
Рис. 3. Участок контакта между двумя гепатоцитами крысы. Обозначения здесь и далее: ЖК - желчный каналец, СК - соединительный комплекс, ПЛС - плотное соединение; ЗС - зона слипания, Д - десмосома, ПС - простое соединение, ЩС - щелевое соединение, З - соединение типа 'замка', ПП - пиноцитозный пузырек, М - митохондрия. Увеличение 50 000
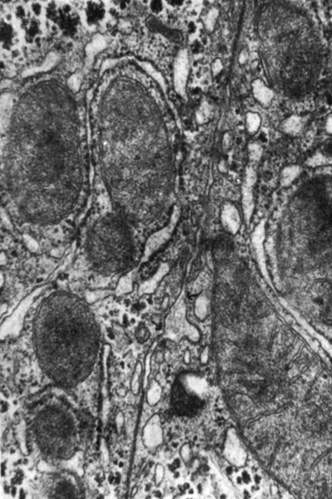
Рис. 4. Локальное расширение межмембранного пространства в простом соединении. Стрелками обозначены границы расширения. Увеличение 36 000
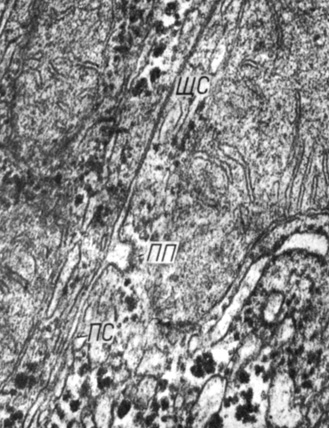
Рис. 5. Пиноцитозный пузырек, образованный плазмолеммой гепатоцита в области простого соединения. Увеличение 54 000
Под плазмолеммами простых соединений располагается зона с незначительно повышенной, по сравнению с гиалоплазмой, электронной плотностью. Ширина этой зоны, называемой подмембранным компонентом, достигает 60 нм. Подмембранный компонент образован микрофиламентами диаметром 4-7 нм и легко обнаруживается при обводнении клеток, при этом происходит просветление гиалоплазмы и его демаскирование. Микрофиламенты подмембранного компонента имеют актиновую природу и способны к активным сокращениям. Эта подповерхностная сократительная система, по-видимому, обеспечивает движение плазмолемм простых соединений. В цитоплазме, прилежащей к плазмолеммам простых соединений, располагаются митохондрии, микротельца, цистерны зернистой и незернистой эндоплазматической сети, гранулы гликогена, микрофиламенты и микротрубочки (рис. 6).
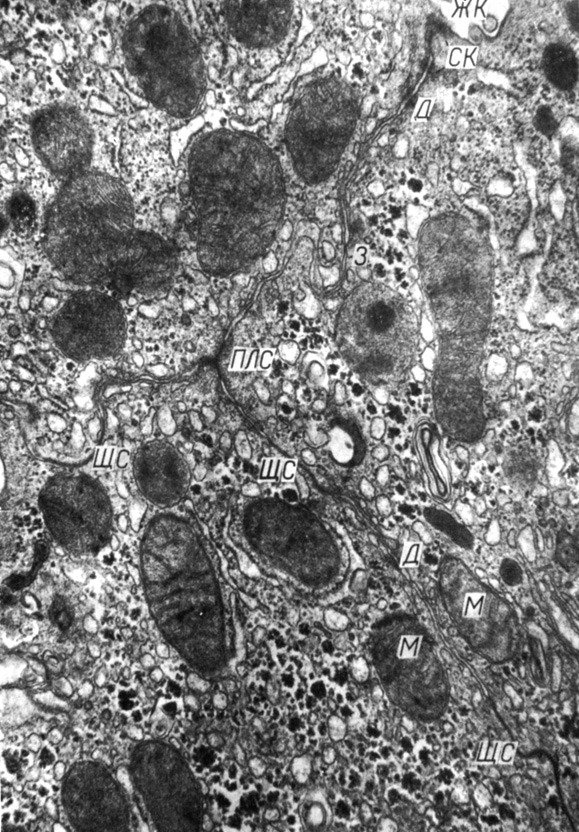
Рис. 6. Область контакта гепатоцитов крысы. Видны особенности контактно-органоидных взаимоотношений в гепатоцитах: митохондрии, симметрично расположенные относительно простого соединения, другие органоиды, прилежащие к контактным структурам. Увеличение 32 000
В различных тканях определяются симметрично расположенные относительно простых соединений органоиды. Описаны конфронтирующие цистерны, микропузырьки, митохондрии (В. И. Архипенко и соавт., 1975; Ю. П. Черненко, 1975). Межмембранное пространство простых соединений может сообщаться с полостями цистерн эндоплазматической сети. В печени демаскирование этих переходов наблюдается при действии четыреххлористого углерода или перфузии печени при повышенном гидростатическом давлении (В. А. Шкурупий, 1975; Swedsen, 1974).
Основными функциями простых соединений являются транспорт веществ между клетками и поддержание их адгезивной связи. Так как в межмембранном пространстве простых соединений располагаются высокогидратированные молекулы гликопротеинов, вдоль простых соединений возможен транспорт веществ путем их диффузии. Движение плазмолемм простых соединений также способствует перемещению веществ между клетками. После внутривенной инъекции крысе ферритина, хлористого лантана или пероксидазы через 1-5 мин эти метки обнаруживают в простых соединениях между различными эпителиоцитами. Движение электронноплотных меток по простым соединениям маркирует естественные токи жидкостей по межклеточным путям. Например, появление меток в простых соединениях энтероцитов свидетельствует о наличии ретроградного, противоположного процессу всасывания, тока жидкости между энтероцитами. Таким образом, простые соединения можно рассматривать как тканевые микроциркуляторные пути.
Простые соединения - структуры высокодинамичные. При различных изменениях и нарушениях жизнедеятельности клеток, функциональных нагрузках и перегрузках, дистрофических и деструктивных процессах, действии метаболических ядов структура простых соединений изменяется. Диапазон этих изменений широк - от нарушения комплементарности плазмолемм и расширения межмембранных пространств до образования широких межклеточных щелей и полостей (Ю. П. Черненко и др., 1973; Ю. П. Черненко, 1975).
Нарушение структуры простых соединений происходит при торможении синтеза и встраивания в контактные поверхности белковых, липидных и углеводных компонентов, а такж при действии внеклеточных факторов, вызывающих деполимеризацию или разрушение гликопротеинов в межмембранных пространствах простых соединений.
Вероятно, простые соединения выполняют коммуникативную функцию, обеспечивая обмен молекулами между контактирующими клетками. Механизм такого взаимодействия может быть связан с экструзией клеткой крупных молекул в межмембранное пространство с помощью микропузырьков и пиноцитозом этих молекул соседней клеткой.
Соединение типа "замка" (junctio digitiformis, studelike junction) представляет собой впячивание плазмолеммы одной клетки в инвагинаты плазмолеммы соседней клетки и является вариантом простого соединения. Плазмолеммы разделены межмембранным пространством шириной 15-20 нм, с низкой, как и в простом соединении, электронной плотностью. Под плазмолеммой располагается слабовыраженный подмембранный компонент, имеющий тонкофиламентозную структуру (рис. 7).
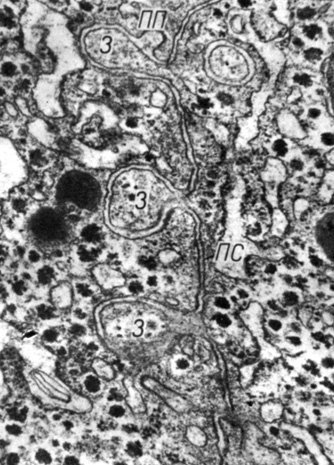
Рис. 7. Соединения типа 'замка' в контакте гепатоцитов лягушки. Увеличение 44 000
Впервые эти соединения выявлены между гепатоцитами печени крыс (D. W. Fawcett, 1953). В кишечном, почечном и переходном эпителиях соединения типа "замка" имеют вид переплетающихся пальцевидных выростов - интердигитаций (P. G. Toner и др., 1971). Соединения типа "замка" не выполняют адгезивной функции (В. Ф. Ушаков, 1978). Они обнаружены в большом количестве между клетками, меняющими форму, высоту и взаиморасположение. Эти соединения являются своеобразными резервами контактных поверхностей, их количество уменьшается или увеличивается при изменении высоты клеток. Учитывая высокую динамичность соединений типа "замка", можно предположить, что они способны легко перемещаться вдоль контакта, выполняя транспортную функцию.
Плотное соединение (zonula occludens, tight junction) расположено между клетками, выстилающими различные полости: эпителиоцитами, эндотелиоцитами, эпендимоцитами (см. рис. 3). Эти соединения связывают апикальные области клеток, располагаясь в виде поясовидной зоны по их периметру. В эпителиях плотные соединения входят в соединительные комплексы, состоящие из трех типов соединений: плотного, зоны слипания и десмосом (рис. 8). Термины "соединительный комплекс" и "плотное соединение" предложены M. G. Farquhar, G. E. Palade (1963). В области плотного соединения наружные листки плазмолемм контактирующих клеток слиты в общий слой толщиной 3 нм. Слияние наружных листков происходит не по всей площади плотного соединения, а вдоль линий, толщина которых составляет 8-10 нм (D. S. Friend, N. B. Gilula, 1972). Линии слияния в плоскости соединения ветвятся и анастомозируют, образуя двумерную сеть. На поперечных ультратонких сечениях плотное соединение при больших увеличениях выглядит как цепочка точечных слияний наружных листков мембран. В неслитых участках между плазмолеммами сохраняется межмембранное пространство шириной до 9 нм. Высота плотных соединений, или их глубина, значительно варьирует в зависимости от типа клеток и может достигать 5 мкм и больше. Минимальные размеры плотного соединения - одно точечное слияние в поперечном сечении или одна линия слияния в плоскости соединения. Такие соединения обнаружены между эндотелиоцитами и некоторыми эпителиоцитами. При исследовании криофрактограмм мембран плотных соединений установлено, что на Р-поверхности располагаются серии внутримембранных частиц, возвышающихся над фосфолипидным полем и имеющих вид гребешков. Гребешки ветвятся и анастомозируют, образуя сеть. На Е-поверхности располагаются комплементарные гребешкам канавки. Расположение внутримембранных частиц соответствует линиям слияния наружных листков плазмолемм (N. S. McNutt, R. S. Weinstein, 1973; N. В. Gilula, 1974). Следовательно, симметрично участкам слияния наружных листков мембран внутри каждой из мембран располагаются серии внутримембранных частиц.
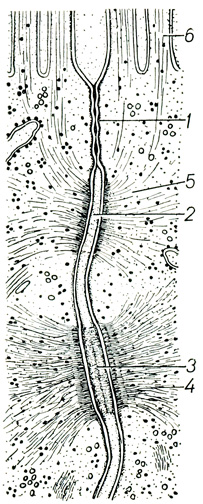
Рис. 8. Схематизированное изображение соединительного комплекса между эпителиоцитами (R. Krstic, 1979): 1 - плотное соединение, 2 - зона слипания, 3 - десмосома, 4 - тонофиламенты десмосомы, 5 - микрофила менты зоны слипания, 6 - микроворсинки на апикальной поверхности эпителиоцита
Число линий слияния в плотном соединении между эпителиоцитами в различных эпителиях неодинаково. Например, в проксимальных канальцах нефрона млекопитающих в плотных соединениях обнаружена только 1 линия слияния, в петле нефрона - 2, дистальном сегменте - 5 и больше анастомозирующих линий (L. A. Staehelin, 1974). В семявыносящих протоках плотные соединения между эпителиоцитами имеют вид густой сети анастомозирующих линий, глубина которой достигает нескольких микрометров (D. S. Friend, N. В. Gilula, 1972). С цитоплазматической стороны к мембранам плотного соединения прилежит электронно- плотная зона шириной до 0,3 мкм. Эта подмембранная область образована микрофиламентами диаметром до 7 нм, расположенными без видимой ориентации и прикрепленными к мембранам соединения. Возможно, что местами прикрепления микрофиламентов служат внутримембранные частицы. Цитоплазма, прилежащая к этому соединению, уплотнена, органеллы приближаются к мембранам соединения не ближе чем на 0,3 мкм. К плазмолеммам других соединений органеллы приближаются до расстояния 10-20 нм. Между эпендимоцитами, мезотелиоцитами, эндотелиоцитами капилляров сердца, мышц и легких плотные соединения представлены не сплошным поясом, а фрагментированы на отдельные участки, между которыми располагаются промежутки или каналы шириной 4-5 нм (R. S. Weinstein, N. S. McNutt, 1972). Такие плотные соединения можно назвать макулярными или прерывистыми. Однако не все эпителиоциты связаны плотными соединениями. Так, между клетками коркового вещества надпочечника они отсутствуют (D. S. Friend, N. B. Gilula, 1972). Кроме того, плотные соединения могут иметь вид отдельных макул, изолированно, вне связи друг с другом, располагающихся в области контакта. Такие соединения обнаружены между клетками панкреатических островков (L. Orci и др., 1973), они получили название фокальных плотных соединений (focal tight junctions). В последних анастомозирующие линии слияния наружных листков плазмолемм также образуют сеть. В ячейках этой сети могут располагаться щелевые соединения.
Плотные соединения выполняют функцию межклеточных барьеров, препятствуя движению веществ через клеточный пласт по парацеллюлярным путям либо обеспечивая их селективный транспорт. Кроме того, они поддерживают адгезивную связь между клетками, сообщая клеточному пласту механическую прочность. Состояние барьерной функции плотных соединений зависит от их ультраструктуры. Так, плотные соединения между эпителиоцитами имеют вид сплошного пояса, однако число линий слияния между различными эпителиоцитами неодинаково. Это определяет прочность и проницаемость соединения.
Плотные соединения, прерывающиеся каналами (макулярные плотные соединения), представляют собой систему межклеточных пор, которые участвуют в селективном транспорте различных веществ через клеточный пласт. Сплошные поясовидные плотные соединения также не являются идеальными межклеточными барьерами. Высокопроницаемые и макулярные соединения проницаемы не только для ионов и микромолекул, но и для макромолекул среднего размера, например пероксидазы хрена (диаметр молекулы 4 нм).
Таким образом, процессы парацеллюлярного транспорта веществ через клеточные пласты определяются состоянием плотных соединений.
Помимо перечисленных функций плотные соединения участвуют в сохранении определенной формы апикальной поверхности клетки. Под последней в прилежащей цитоплазме располагается в виде тента сеть микрофиламентов, местами прикрепления которой служит цитоплазматическая поверхность мембраны плотного соединения. Натяжение этой сети обеспечивает, например, поддержание уплощенной формы апикальной поверхности эндотелиальных клеток. Структура плотных соединений динамична. При действии химических факторов в физиологических и экспериментальных условиях она может изменяться, модулируя изменение проницаемости клеточного пласта. При различных механических нагрузках на эпителиальный пласт, приводящих к его растяжению, нарушается геометрическая структура плотных соединений: ячейки сети, образованной линиями слияния наружных листков мембран, приобретают вытянутые контуры (B. E. Hull, L. A. Staehelin, 1976).
Выделяют три вида соединений слипания: зона слипания (zonula adherens), фасция слипания (fascia adherens) и пятно слипания, или собственно десмосома (macula adherens, desmosoma). Зона слипания является элементом соединительного комплекса и располагается непосредственно под плотным соединением, окружая в виде сплошного пояса апикальные области клеток. В соединительном комплексе она занимает промежуточное положение между плотным соединением и десмосомами (рис. 3, 8), поэтому ее еще называют промежуточным соединением (M. G. Farguhar, G. E. Palade, 1963). Плазмолеммы в области этого соединения находятся на расстоянии 15-25 нм друг от друга. Межмембранное пространство заполнено филаментозным материалом, плотность которого повышена по сравнению с простым соединением. По молекулярному составу содержимое межмембранного пространства зоны слипания относят к гликопротеинам (R. D. Campbell, J. H. Campbell, 1971; N. S. McNutt, R. S. Weinstein, 1973). На криофрактограммах мембран зон слипания на Е-поверхности обнаружено меньше глобулярных частиц, чем в области простого соединения. На Р-поверхности расположение и количество глобулярных частиц такое же, как в простых соединениях. Под мембранами зон слипания находится скопление сократительных микрофиламентов диаметром 7 нм, которые представляют собой фибриллярный актин (F-актин). Микрофиламенты прикрепляются к цитоплазматической поверхности мембран зон слипания. Считают, что внутримембранные частицы представляют собой внутримембранные сегменты этих филаментов (L. A. Staehelin, 1974). Подмембранные микрофиламенты формируют густую сеть, распространяющуюся в прилежащую цитоплазму на глубину до 0,5 мкм (см. рис. 3, 8) и образующую контрактильное кольцо в апикальной области клетки. Плотные соединения и зоны слипания являются, таким образом, местами фиксации микрофиламентов, сокращение которых может вызвать внутриклеточные перемещения органоидов и изменение объема апикальных областей клеток. В однослойных эпителиях микрофиламенты, прикрепляясь к мембранам плотных соединений и зон слипания, входят в микроворсинки. Сокращение микрофиламентов вызывает движение микроворсинок на апикальной поверхности клеток (R. Rodewald и др., 1976). Зоны слипания выполняют две основные функции: поддерживают адгезивную связь между клетками и служат местами фиксации внутриклеточной контрактильной системы.
Фасция слипания в сечениях и на сколах имеет однотипную с зоной слипания структуру. Это соединение обнаружено между гладкомышечными клетками и миоцитами сердца в составе вставочных дисков (N. B. Gilula, 1974; N. S. McNutt, 1975). Фасция слипания представляет собой макулярную структуру, имеющую в плоскости контакта диаметр до 5 мкм. К мембранам этой фасции прикреплены, как и в зоне слипания, F-активные микрофиламенты, образующие в прилежащей цитоплазме филаментозную сеть.
Основная функция фасций слипания - поддержание определенной величины адгезивной связи между клетками. В сердечных миоцитах к филаментозной сети фаснии слипания прикреплены актиновые филаменты миофибрилл. Фасции слипания, как и зоны слипания, являются местами фиксации внутриклеточной сократительной системы.
Десмосома представляет собой дисковидную структуру, диаметр которой в плоскости контакта составляет 0,1-0,5 мкм. Десмосомы выявлены между эпителиоцитами, гладкомышечными клетками, миоцитами миокарда и эндотелиоцитами некоторых сосудов. В эпителиальных тканях они входят в состав соединительных комплексов, располагаясь под зонами слипания и, кроме того, свободно распределены по площади клеточного контакта (см. рис. 3, 6, 8).
Межмембранное пространство десмосом шириной 25-35 нм заполнено филаментозным материалом. В межмембранном пространстве располагается центральная электронноплотная пластинка толщиной 5 нм, связанная филаментами (см. рис. 8) с каждой из мембран (R. D. Campbell, J. H. Campbell, 1971). При импрегнации солями La межмембранного пространства десмосом сердечных миоцитов установлено, что центральная пластинка связана с обеими мембранами тонкими филаментами, фрагменты которых обнаруживаются в виде частиц диаметром 4 нм (D. G. Rayns и соавт., 1969).
С цитоплазматической стороны к мембранам десмосом прилежат электронноплотные пластинки толщиной 20 нм, отделенные от мембран прозрачной зоной шириной 8 нм. С десмосомными пластинками связаны толстые (диаметром 10 нм) филаменты - тонофиламенты. Последние, входя в площадку и выходя из нее, прикрепляются к ней в виде петель.
Исследование реплик со сколов мембран десмосом показало, что на Р- и Е-поверхностях располагаются частицы диаметром 9-10 нм, с различной плотностью упаковки. Расположение частиц на обеих поверхностях асимметричное, на Е-поверхности обычно находится скопление частиц, на Р-поверхности они размещаются более редко (D. E. Kelly, F. L. Shienvold, 1976). Внутримембранные частицы имеют белковую природу и, возможно, являются внутримембранными сегментами филаментов, связывающих десмосомные пластинки с компонентами межмембранного материала. При исследовании ультраструктуры изолированных десмосом установлено, что к пластинкам помимо тонофиламентов прикрепляются и микрофибриллы двух типов: диаметром 4-5 нм и 5-6 нм (C. J. Skerrow, A. G. Matoltsy, 1974).
На рис. 9 отражен план строения десмосомы, реконструированной по данным ультраструктурных исследований. При гомогенизации тканей десмосомы не разрушаются, что позволяет с помощью последующего ультрацентрифугирования выделить фракцию десмосом. Изолированные эпидермальные десмосомы содержат до 76% протеинов, 17% углеводов и около 10% липидов (A. G. Matoltsy, 1975). Основная часть белка десмосом (фибропротеина) локализована в пластинках. В межмембранной области располагаются гликопротеины. Химическая структура их различна. Об этом косвенно свидетельствует неодинаковая чувствительность десмосом различных эпителиальных тканей к хелатам и протеазам. Так, десмосомы кишечного эпителия чувствительны к ЭДТА и резистентны трипсину; эпителия ротовой полости - резистентны к ЭДТА; переходного эпителия - чувствительны к ЭДТА и трипсину; железистого и многослойного ороговевающего эпителия - резистентны к ЭДТА, но чувствительны к трипсину (J. Z. Rosenblith, J. P. Revel, 1972; D. J. Scaletta, D. K. McCallum, 1972). Следовательно, несмотря на сходство или однотипность ультраструктурной организации, молекулярная структура десмосом может существенно различаться. Считается, что функция десмосом в основном заключается в поддержании адгезивной связи между клетками. В многослойных эпителиях клетки связаны большим количеством десмосом. Число десмосом между эпителиоцитами достигает 800-2000 на одну клетку. Со стороны цитоплазмы клетки десмосомы являются местами прикрепления пучков тонофиламентов, формирующих скелетную систему клетки. Цитоскелетную систему, построенную из тонофиламентов и десмосомных пластинок, рассматривают как своеобразный протектор - "организатор напряжений", обеспечивающий кооперативное распределение нагрузок между клетками при механических нагрузках на ткань, что предупреждает чрезмерную деформацию и повреждение клеток (L. A. Staehelin, 1974). Эта сторона функционирования десмосом наиболее выражена в тканях, несущих механические нагрузки, и в сократительных тканях: эпидермисе, миокарде, гладких мышцах.
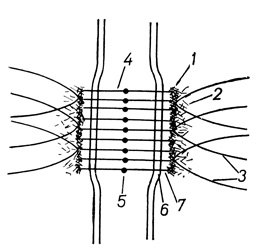
Рис. 9. План строения десмосомы, реконструированной по данным ультраструктурных исследований: 1 - цитоплазматическая пластинка десмосомы, 2 - микрофиламенты, 3 - тонофиламенты, 4 - филаменты, соединяющие цитоплазматические пластинки, 5 - область соединения филаментов (центральная электронноплотная площадка), 6 - внутримембранные сегменты филаментов, 7 - цитоплазматические сегменты филаментов
Десмосомы являются динамичными структурами. В многослойных эпителиях по мере продвижения эпителиоцитов в поверхностные слои меняются размеры и количество десмосом между клетками. С цитоплазматической стороны к десмосомным пластинкам могут тесно примыкать некоторые органеллы. В эпителии семявыносящих протоков печени млекопитающих выявлены десмосомо-митохондриальные и десмосомо-пероксисомные комплексы, в которых митохондрии и пероксисомы симметрично расположены относительно десмосом. Считают, что эти комплексы отражают этапы синтеза десмосом либо коммуникативный процесс между клетками (L. Sternlieb, 1968).
Щелевое соединение, или нексус (nexus, gap junction), представляет собой макулярную структуру, имеющую в плоскости МК диаметр 0,1-5 мкм. На ультратонких сечениях щелевые соединения выглядят как области контакта, где наружные листки плазмолемм разделены промежутком 2-4 нм. С помощью различных методов фиксации тканевых образцов обнаружена разной степени сохранность структуры щелевого соединения. Неоднородность получаемой при этом электронномикроскопической картины обусловила появление большого количества терминов, обозначающих эту структуру: плотные соединения, плотные контакты, пятислойные соединения, семислойные соединения, отдаленные зоны плотного контакта, фокальные плотные контакты, щелевые соединения, нексусы, близкие соединения. Введение фиксации глютаровым альдегидом с последующей дофиксацией четырехокисью осмия и контрастированием тканевых блоков уксуснокислым уранилом, повышающим контраст наружных листков плазмолемм, позволяет наиболее адекватно сохранить ультраструктуру щелевых соединений (рис. 10). В настоящее время приняты два термина для обозначения этого типа соединений: щелевые соединения, или нексусы.
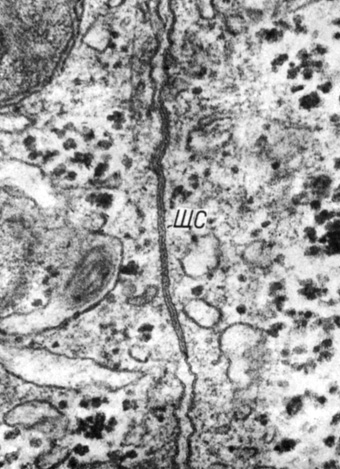
Рис. 10. Щелевое соединение между гепатоцитами крыс. Наружные листки плазмолемм разделены узкой щелью шириной 3 нм. Увеличение 90 000
С помощью метода импрегнации МК гидроокисью La появилась возможность четко идентифицировать плотные и щелевые соединения (J. P. Revel, M. J. Karnovsky, 1967). В плотные соединения гидроокись La не проходит, однако она легко проникает в межмембранные простанства щелевых соединений. При этом если ультратонкий срез проходит строго перпендикулярно плоскости щелевого соединения, то межмембранное пространство представляет собой электронноплотную зону шириной до 5,5 нм; если же срез проходит тангенциально, то в межмембранном пространстве обнаруживаются гексагонально упакованные частицы, промежутки между которыми заполнены гидроокисью La. Расстояние между центрами частиц 9-10 нм, в центре каждой частицы располагается электронноплотная точка диаметром 1,5-2 нм, плотность упаковки частиц 6200 на 1 мкм2 (N. В. Gilula, 1974; L. A. Staehelin, 1974).
Межмембранные частицы - полые трубочки, внутри которых проходят гидрофильные каналы. Трубочки ориентированы пер-пендикулярно плоскости соединения и проходят через обе его мембраны. При исследовании реплик со сколов мембран щелевого соединения установлено, что на Р-поверхности располагаются гексагонально упакованные частицы диаметром 6-11 нм, с расстоянием между центрами их 7-12 нм, на Е-поверхности - комплементарные частицам углубления с несколько меньшим диаметром - 3-8 нм. В центре каждой частицы находится углубление диаметром 2-2,5 нм (С. Peracchia, 1977). Выделена морфофункциональная единица щелевого соединения, которой соответствует сложный макромолекулярный комплекс, образованный двумя внутримембранными частицами, принадлежащими соседним клеткам и соединенными в области межмембранного пространства. Этот комплекс получил название коннексона (D. A. Goodenough, 1976). Через весь коннексон проходит гидрофильный канал, соединяющий цитоплазмы контактирующих клеток. Из таких повторяющихся единиц и построены щелевые соединения.
Небольшие участки щелевых соединений обнаружены в ячейках сети плотных соединений между эпителиоцитами, эндотелиоцитами, клетками панкреатических островков (D. S. Friend, N. В. Gilula, 1972; L. Orci и др., 1973). В зависимости от диаметра внутримембранных частиц выделено три типа щелевых соединений: 1-й - частицы диаметром 9-10 нм, 2-й-10-11 нм, 3-й-6 нм (L. A. Staehelin, 1974). Эти соединения относят к щелевым соединениям А-типа (типы А-1, А-2, А-3), поскольку на сколах внутримембранные частицы расположены только на Р-поверхностях (по старой номенклатуре, на А-поверхностях). Соединения А-типа преимущественно обнаружены между различными клетками позвоночных. Соединения, в которых внутримембранные частицы располагаются на сколах на Е-поверхностях (В-поверхностях, по старой номенклатуре) выявлены у беспозвоночных. Такие соединения называются соединениями В-типа (N. E. Flower, 1977). Различия в структуре МК у позвоночных и беспозвоночных описаны далее.
Щелевые соединения различаются не только размером внутримембранных частиц, но и плотностью их упаковки. Так, у планарий в щелевых соединениях А-типа плотность упаковки частиц на Р-поверхности скола изменяется от 1300 до 7000 на 1 мкм2 (D. S. Quick, R. G. Johnson, 1977). Помимо гексагональной обнаружена и ромбовидная упаковка частиц.
С цитоплазматической стороны к мембранам щелевых соединений могут близко подходить, контактируя с ними, цистерны гранулярной эндоплазматической сети, митохондрии, свободные рибосомы, микропузырьки (рис. 11). Очевидно, такие контактно - органоидные взаимоотношения отражают особенности установившихся между клетками метаболических связей. Щелевые соединения выявлены между самыми различными клетками многоклеточных организмов. Они являются обязательным элементом МК и связывают не только однотипные, но и разнотипные клетки: нейроциты и глиальные клетки, отростки нейроцитов и одонтобласты, и клетки панкреатических островков (L. A. Staehelin, 1974; D. A. Goodenough, 1975; C. Peraccnia, 1977).
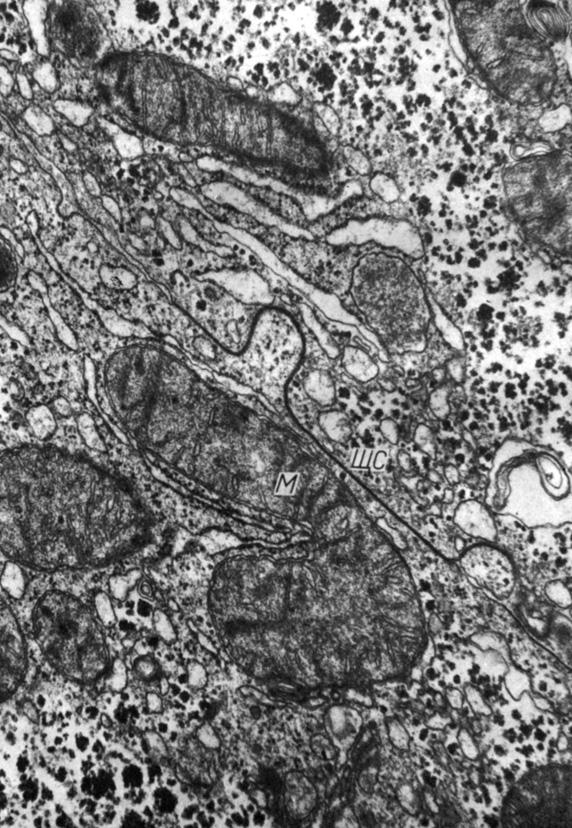
Рис. 11. Щелевое соединение между гепатоцитами крысы. Близкое расположение митохондрий у щелевого соединения. Увеличение 35 000
Щелевые соединения в нервной ткани получили название электрических, или эфаптических, синапсов. Положение щелевых соединений в области контакта не статично, они могут перемещаться вдоль контактных поверхностей клеток.
Основная функция щелевых соединений заключается в поддержании ионной и метаболической связи между контактирующими клетками. Через щелевые соединения осуществляется перенос ионов и различных микромолекул, регуляторных и информационных молекул, таких как циклический 3', 5' - АМФ, РНК, низкомолекулярные белки с молекулярной массой до 10 000 (N. B. Gilula, 1974; C. Peracchia, 1977). Более крупные белковые молекулы могут проходить через соединения только после их фиксации глютаровым альдегидом. Наличие нескольких морфологических типов щелевых соединений, возможно, связано с их функциональной специализацией для переноса различных молекул.
В функциональном отношении щелевые соединения - высокодинамичные структуры, их проницаемость для ионов и молекул зависит от состояния энергетического метаболизма клеток, белкового синтеза, внутриклеточной концентрации ионов Са2+. Таким образом, щелевые соединения представляют собой специализированные каналы межклеточной связи с огромной информационной емкостью.
К септированным, или септосодержащим, соединениям (septate junctions) относят несколько разновидностей соединений, в межмембранном пространстве которых располагаются перемычки, или септы, соединяющие плазмолеммы. Эти соединения встречаются главным образом в эпителиях беспозвоночных. Впервые септированные соединения выявлены между эпидермальными клетками гидры R. L. Wood (1959), который назвал эти соединения септированными десмосомами. Термин этот, однако, не получил распространения, так как эти соединения имеют мало общего с десмосомами.
Основные отличия между типами септосодержащих соединений заключаются в морфологической структуре септ. Так, у гидры септированные соединения сплошным поясом окружают апикальные области эпидермальных и гастродермальных клеток. Межмембранное пространство этих соединений шириной 15-20 нм заполнено септами толщиной 2-3 нм, соединяющими мембраны. Расстояние между септами 4-5 нм. Гидроокись La и рутений красный могут проникать в межмембранное пространство этих соединений, при этом в тангенциальных сечениях выявляются негативно контрастированные септы, образующие трехмерную гексагональную сеть между мембранами (A. R. Hand, S. Gobel, 1972). Такого же типа соединения обнаружены между эпителиальными клетками гидромедуз и планарий.
У насекомых обнаружены септированные соединения, отличающиеся от таких же соединений гидроидного типа. Эти соединения также окружают апикальные концы эпителиальных клеток. На поперечных сечениях их в межмембранных пространствах, ширина которых составляет 15 нм, располагаются септы толщиной 5 нм, связывающие мембраны. Исследование тангенциальных срезов соединений, обработанных гидроокисью La, показало, что септы представляют собой ряды межмембранных перемычек, идущих вдоль соединения. Каждая септа выглядит как частокол, составленный из цилиндрических перемычек толщиной 5 нм, промежутки между которыми заполнены веществом гликопротеиновой природы. Расстояние между септами составляет 14 нм (N. B. Gilula и др., 1970). На тангенциальных сечениях перемычки, из которых составлены септы, расположены гексагонально, из-за чего межмембранная область соединения имеет сотовидную структуру. В связи с этим соединения такого типа получили название сотовидных септированных соединений.
Сотовидные септированные соединения содержат многие десятки рядов септ, идущих параллельно апикальному периметру клеток, глубина соединений в апикально-базальном направлении достигает нескольких микрометров. Эти соединения занимают большую часть площади на контактных поверхностях клеток. Площадь септированного соединения составляет 30% всей клеточной поверхности. На сколах мембран септированных соединений этого типа на Р-поверхности располагаются ряды внутримембранных частиц диаметром 8,5 нм, идущих вдоль соединения, на Е-поверхностях - комплементарные им ряды ямок (N. B. Gilula и др., 1970).
Септосодержащие соединения обоих типов поддерживают адгезивную связь между клетками и создают межклеточный барьер.
В печеночном выросте дафний и между эпителиоцитами средней кишки термитов выявлен третий тип септосодержащих соединений - непрерывные соединения. На поперечных сечениях их межмембранное пространство шириной 11-15 нм заполнено непрерывным плотным, тонкогранулярным материалом, содержащим гликопротеины. Создается впечатление, что плазмолеммы соединены одной лентовидной септой глубиной в несколько микрометров. Пенетрация межмембранного пространства гидроокисью La позволила обнаружить, что сплошная электронноплотная зона в межмембранном пространстве соединения состоит из многих рядов непрерывных извитых лентовидных септ толщиной 4-5 нм, расположенных параллельно друг другу по глубине соединения. Ширина промежутков между септами составляет всего 3,5 нм, в них располагаются перемычки цилиндрической формы диаметром 2-5 нм, соединяющие плазмолеммы (A. J. Hudspeth, J. P. Revel, 1971; N. B. Gilula, 1971).
Функция непрерывного септированного соединения, как и соединений первых двух типов,- окклюзия межклеточных областей. Септированные соединения не выполняют, как это считали ранее, коммуникативную функцию, ее обеспечивают щелевые соединения, располагающиеся, наряду с септированными, в областях МК.
Приведенные данные показывают, что МК представляют собой сложные структуры, с помощью которых каждая тканевая клетка "подключена" к соседним клеткам (рис. 12, А, Б). Благодаря контактным структурам, клетки соединены в клеточный массив - ткань. Динамичность структуры клеточных соединений свидетельствует о важной роли МК в организации жизнедеятельности ткани и регуляции тканевых свойств.
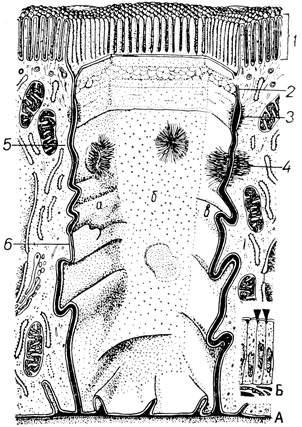
Рис. 12. Схематизированное изображение контактных структур, с помощью которых эпителиоциты соединены друг с другом (Л) и положение рассматриваемого энтероцита в участке кишечного эпителия (Б): 1 - микроворсинки на апикальной поверхности, 2 - плотное соединение, 3 - зона слипания, 4 - десмосома, 5 - простое соединение, 6 - щелевое соединение, а, б, в - участки контактной поверхности, с помощью которых данная клетка 'подключена' к каждой из соседних клеток (R. Krstic, 1979)
В настоящее время исследования структуры и функции МК направлены в основном на выяснение молекулярной природы клеточных соединений и молекулярных механизмов, обеспечивающих их функцию.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'