
Факторы, регулирующие состояние межклеточных контактов (Пинская В. М., Меликяц А. Г., Маленков А. Г., Ямская В. П.)
Роль ионов кальция и величины рН в поддержании структуры и функции межклеточных контактов (Пинская В. М., Меликяц А. Г.)
Непосредственно определяют свойства МК двухвалентные ионы и специфические макромолекулы, формирующие межклеточный цемент. Влияние их важно для понимания природы МК, возможных механизмов их регуляции. Знание этих вопросов необходимо также для оценки роли МК в патологических процессах, выбора оптимальных путей воздействия на ткани при лечении, разработки новых способов диагностики, прогнозирования и терапии тех видов патологий, при которых тканевой уровень повреждения является ведущим.
При введении в кровь больных с терапевтической целью ионов Ca2+, Na+, некоторых гормонов, сильно влияющих на ионный баланс (например, кальцитонина, комплексонов), а также при распространенных патологических процессах, приводящих к нарушениям организменного гомеостаза ионов (ацидоз, нарушение функции почек), концентрация протонов, щелочных и щелочноземельных ионов во внутренних средах может изменяться в таких пределах, что это сказывается на состоянии МК (прежде всего, пограничных эпителиальных тканей).
Роль Ca в жизнедеятельности клеточной поверхности разно-образна. Он необходим для осуществления ферментативных реакций, обусловливающих участие клеточной поверхности в выполнении различных функций: транспорта веществ, действия гормонов, размножения клеток, механизмов сокращения, проведения возбуждения и др. Ионы Ca2+ обеспечивают жесткую конформацию и проницаемость клеточной поверхности. Кроме того, они являются обязательным компонентом сложного механизма межклеточной адгезии.
Абсолютная необходимость ионов Ca2+ для существования многоклеточной системы как единого целого была открыта еще в прошлом веке. В бескальциевой среде наблюдали дезагрегацию эмбрионов амфибий, пресноводных олигохет и морских ежей. Ионы Ca2+ способны стимулировать реагрегацию диссоциированных клеток, прилипание клеток разных видов ткани к поверхности стекла. Добавление Ca2+ в инкубационную среду способствовало увеличению сцепленности клеток. Для осуществления адгезии необходима определенная концентрация Ca2+ в межклеточном пространстве. L. Weiss (1960) отметил, что адгезия клеток к стеклу возрастает при увеличении количества Ca2+ в среде от 0,003 до 0,03 мг/мл. Дальнейшее повышение концентрации приводит к уменьшению адгезии. Агрегация слизевика Dictyostelium discoideum не происходит, если количество Ca2+ в среде ниже 10-6 моль, и достигает максимальной скорости, если оно возрастает до 10-4 моль. Адгезивные свойства поверхности изменяются по мере увеличения концентрации Ca2+ в меж-клеточной среде. Сегментоядерные нейтрофильные гранулоциты человека при содержании кальция в среде ниже 1,5⋅10-3 моль прикрепляются к стеклу, при 1,5-2⋅10-3 моль - к поверхности монослоя, при 3⋅10-3 моль - слипаются друг с другом в суспензии.
Для реализации действия Ca2+ необходима оптимальная температура. J. М. McDonald с соавторами (1976) установили, что скорость связывания Ca2+ плазмолеммами максимальна при температуре 24-37° С и резко уменьшается при снижении и повышении ее. Адгезия клеток ВНК-21 к покрытым желатиной стенкам сосуда не происходила при температуре ниже 8° С, становилась заметной только при температуре выше 12° С, затем с повышением температуры увеличивалась.
Некоторые другие двухвалентные катионы оказывают на меж-клеточную адгезию эффект, подобный Ca2+, но менее выраженный. Е. А. Модянова (1970) обнаружила, что Mg2+ и Sr2+ оказывают аналогичное Ca2+ действие на адгезию гепатоцитов лишь в более высоких концентрациях. Так, Mg++ и Ca2+ стимулируют реагрегацию клеток куриных эмбрионов, Ca2+ и Sr2+ увеличивают адгезию эпителиальных клеток мочевого пузыря, a Sr2+ - клеток куриных эмбрионов. Mg2+ больше, чем Ca2+, способствует адгезии фибробластов к покрытым белком пластмассовым субстратам. Не только Ca2+, но и другие щелочноземельные катионы способны восстанавливать при добавлении их в инкубационную среду исходный уровень ионной проницаемости и сцепленности клеток эпителиального пласта кишок крысы. При этом распределение их по эффективности следующее: Ca2+>Ba2+>Mg2+>Sr2+ (А. Г. Меликянц, 1976).
По-видимому, избирательное влияние катионов на адгезивные свойства поверхности разных типов клеток зависит от химического состава их мембран. Катионы влияют на слипание искусственных мембран. Распределение их в ряду по эффективности зависит от химического состава мембран. Для мембран из фосфолипидов мозга: Ba2+>Sr2+>Be2+>Zn2+>Ca2+>Mg2+, для мембран из окисленного холестерина: Ba2+>Be2+>Sr2+>Ca2+>Zn2+>Mg2+.
Ca связывается с белками клеточной поверхности и межклеточного цемента. Так, присутствие в среде двухвалентных катионов (Ca2+ и Mg2+) необходимо для прилипания клеток к поверхности стекла или пластика, покрытой белком. Ca2+ ускоряет агрегацию клеток HeLa в суспензии, но не влияет на нее после обработки клеток трипсином. Солюбилизация мембранных белков теней эритроцитов значительно увеличивается при инкубации в растворе ЭДТА. В изолированных мембранах сарколеммы миокарда крысы Ca2+ связан с белками, имеющими молекулярную массу 100 000. Обработка мембран проназой и трипсином снижает количество участков связывания Ca2+; нейраминидаза, фосфолипаза А, С и D почти не оказывают влияния. Для прилипания лейкоцитов человека к стенкам флаконов необходимы ионы Са2+ и Mg2+. Блокирование SH-групп клеточных белков и подавление гликолитических реакций противодействуют прилипанию лейкоцитов.
От 40 до 60% клеточного Ca2+ в эритроцитах разных видов животных локализовано в мембране. Из них 60% ионов Ca2+ связано с внешней и 40% -с внутренней поверхностью мембраны теней эритроцитов. В тенях эритроцитов 80% Ca2+ соединено со свободными карбоксильными группами аминокислот и 15-20% - с фосфатными группами кислых фосфолипидов.
Белки клеточной поверхности - необходимый компонент адгезивных структур. В процессе жизнедеятельности клетки мембранные элементы постоянно обновляются. С помощью некоторых антибиотиков, в частности актиномицина, можно затормозить включение меченых аминокислот в плазмолемму и создать дефицит белковых компонентов клеточной поверхности. При введении крысам разных доз актиномицина величина сцепленности МК гепатоцитов снижалась почти вдвое и нарушалась нормальная структура контактов. Последнее обнаруживалось через 6 ч после инъекции большой дозы и через 3-4 дня после ежедневных инъекций малых доз актиномицина. Происходило нарушение простых соединений и соединений типа "замка". Вначале изменялась комплементарность плазмолемм, затем межмембранные пространства расширялись до 40-80 нм (рис. 31). В ряде случаев обнаруживались широкие щели, разделяющие соседние гепатоциты. Уменьшалась плотность подмембранного компонента в области простых соединений. Специализированные структуры контактов сохранялись.
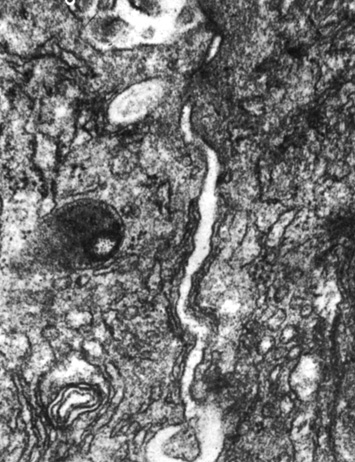
Рис. 31. Расширение межмембранного пространства и нарушение параллельности плазмолемм в области простого соединения гепатоцитов крысы через 24 ч после введения актиномицина. Увеличение 50 400
Через 24 ч после инъекций актиномицина крысам вводили кальция глюконат и исследовали величину сцепленности гепатоцитов. Она не изменялась, т. е. увеличение концентрации Ca++ в межклеточном пространстве не влияло на адгезивные свойства поверхности. Однако в ходе эксперимента было обнаружено гипокальциемическое действие актиномицина (В. И. Архипенко и др., 1974). Опыт был повторен по той же схеме на культуре L-фибробластов. В отличие от опыта in vivo, инкубация фибробластов в течение 1 ч в среде с повышенной концентрацией Ca2+ не изменила величины адгезии. Актиномицин, введенный в культуральную среду за сутки до исследования, значительно уменьшил адгезию клеток к стеклу. Величина адгезии клеток, культивировавшихся в среде с актиномицином и Ca2+, была достоверно ниже, чем в контроле.
В следующем опыте через 24 ч после инъекции актиномицина крысам вводили гипокальциемический гормон кальцитонин. Введение этого гормона углубляло гипокальциемию, вызванную актиномицином, но не влияло на величину сцепленности гепатоцитов и не вызывало дополнительных нарушений ультраструктуры контактов (рис. 32). При перфузии раствором ЭДТА печени крыс, получавших актиномицин, происходило разрушение структур контактов в такой же последовательности, как и при перфузии печени интактных крыс, только этот процесс начинался раньше и протекал значительно быстрее.
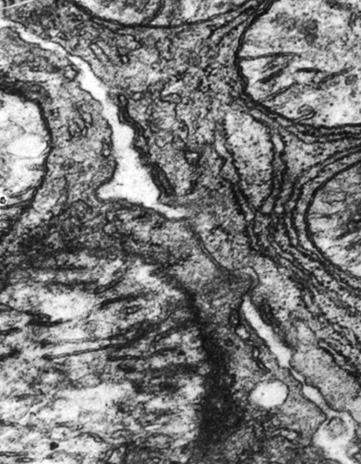
Рис. 32. Расширение межмембранного пространства и нарушение параллельности плазмолемм в области простого соединения гепатоцитов крысы после введения актиномицина и тирокальцитонина. Увеличение 50 000
Можно предполагать, что актиномицин блокировал синтез рецепторов для Ca2+, связь с которыми обусловливает его участие в механизме адгезии. Если это так, то рецепторы - короткоживущие соединения, имеющие нестойкие матрицы, так как описанные эффекты проявляются через непродолжительное время после введения актиномицина.
Использование метода диспергирования ткани позволило установить, что вещество, выделенное из МК, состоит из белка, содержащего углеводы. По данным электронной микроскопии, видоспецифический фактор агрегации губок имеет вид кольца с расходящимися от него ветвями. Это кислый белково-углеводный комплекс с молекулярной массой 20 ⋅ 106). Действие фактора агрегации зависит от Ca2+ и Mg2+.
Имеются сведения о том, что Ca2+ в клеточной поверхности может быть связан с мукополисахаридами. Инактивация Ca++ при обработке ЭДТА облегчает диспергирование ее коллагеназой и гиалуронидазой.
На основании данных обработки плазмолемм клеток печени фосфолипазой и нейраминидазой высказано предположение, что Ca2+ связан с остатками нейраминовой кислоты и кислыми фосфолипидами. C. E. Bugg, W. J. Cook (1973), основываясь на результатах собственных исследований, предложили структурные модели, объясняющие механизмы связывания Ca2+ с углеводами. Существуют экспериментальные подтверждения связи Ca2+ с липидными компонентами клеточной поверхности. Установлено, что обработка протеолитическими ферментами поверхностных мембран скелетных мышц лягушки уменьшает выход Ca2+, а липолитическими - увеличивает. Исследование адсорбции 45Ca на липидных монослоях показало, что местом реакции Ca2+ у разных липидов могут быть карбоксильные и фосфатные группы. Приведенные данные свидетельствуют о том, что поверхности разных типов клеток, вероятно, имеют различные наборы анионов, связывающих Ca2+. Эти анионы могут принадлежать белковым, липидным и углеводным компонентам клеточной поверхности.
По площади клеточной поверхности Ca2+ распределен неравномерно. На поверхности адипоцитов наблюдаются участки высокого и низкого сродства к ионам. В изолированных мембранах сарколеммы миокарда крысы имеются участки, обладающие разной способностью связывать Ca2+ (C. J. Limas, 1977). При ультрацитохимическом исследовании клеток миокарда наиболее высокое содержание этих ионов обнаружено в области вставочных дисков. Центры, связывающие Ca2+ в эпителии кишок таракана, расположены на апикальных и латеральных поверхностях клеток. В сарколемме поперечнополосатых мышц методом электронной микроскопии не выявлено локальных отложений Ca2+.
Ценные сведения о преимущественной локализации Ca2+ в структурах МК и роли комплексов Ca2+ с компонентами клеточной поверхности в межклеточной адгезии получены при помощи обработки тканей бескальциевыми растворами и связывания Ca2+ в контактах ЭДТА. В результате 35-минутной обработки слизистой оболочки желудка раствором ЭДТА в обкладочных клетках разрушается 77% десмосом, вымывается межклеточное вещество и увеличивается межмембранное пространство в зонах слипания. Плотные контакты сохраняются. Р. K. Jingal с соавторами (1979) наблюдали изменение окрашивания вставочных дисков и средней пластинки в плотном соединении после 5-минутной перфузии изолированного сердца крысы. Инкубация доли поджелудочной железы в хелатном растворе в течение 1-2 ч приводила к разрушению плотных контактов. Добавление Ca2+ в среду восстанавливало их структуру (J. Meldolesi и др., 1978). При перфузии печени мыши бескальциевым раствором морфологические изменения в контактах развивались в такой последовательности (Л. В. Ольшевская, Е. А. Модянова, 1971). В первую очередь увеличивалось межмембранное пространство в области простых соединений, обнаруживалось расхождение клеток в области "замка", вымывание межклеточного вещества в районах десмосом. Затем отмечалось разобщение плотных соединений и в последнюю очередь - щелевых. На обнажившихся поверхностях клеток появлялись многочисленные микроворсинки.
Ю. П. Черненко (1975) через 10 мин после начала перфузии печени крысы раствором ЭДТА наблюдал первые признаки изменения ультраструктуры контактов. Обнаруживались участки нарушения простых соединений, увеличение межмембранного пространства до 0,1-0,2 мкм. Через 15 мин между гепатоцитами образовывались широкие щели, часто идущие от субэндотелиального пространства к соединительным комплексам. Разрушались десмосомы и зоны слипания, их плазмолеммы расходились. Плотные и щелевые соединения сохранялись. Желчные капилляры не нарушались. Через 20 мин после начала перфузии клетки были полностью изолированы друг от друга, разделены широкими щелями. Контактные структуры между ними отсутствовали. На бывших контактных поверхностях сохранялись микроворсинки желчных капилляров. Плазмолеммы в плотных и щелевых соединениях не расходились, а отрывались от одной из клеток. В результате этого плотные и щелевые соединения оказывались расположенными на поверхности одной из соседних клеток. 20-минутная перфузия печени крыс раствором Хенкса нормального состава не приводила к изменению ультраструктуры контактов гепатоцитов.
Аналогичные эксперименты проведены Е. Г. Ивановской и со-авторами (1974). Однако они обнаружили, что 20-минутная перфузия печени бескальциевым раствором и раствором, содержащим ЭДТА, не изменяет ультраструктуру МК. В редких случаях авторы наблюдали расширение межмембранного пространства в области простого соединения гепатоцитов. Хлористый лантан выявлялся в виде электронноплотного материала, заполняющего простые соединения. После 1,5-часовой перфузии обнаружены различные изменения ультраструктуры контактов: от небольших расширений простого соединения до полного расхождения клеток. Отмечены разрушения десмосом и щелевых соединений, при полном расхождении клеток разрушались и плотные соединения. La в этих случаях заполнял все межклеточное пространство, включая и область желчного капилляра.
Неоднозначность результатов, полученных в этих двух опытах, по-видимому, объясняется разными условиями их проведения. При высокой концентрации хелатов и большом давлении в системе может происходить быстрая декальцинация мембран и ослабление их прочности. В таком случае мембраны под действием гидростатического давления разрушаются быстрее, чем специализированные структуры контактов.
Удаление двухвалентных катионов из ткани значительно увеличивает ионную проницаемость эпителия, которая затем восстанавливается при последующем добавлении Ca2+. Можно выделить три фазы этого процесса. Первая (обратимая), в течение которой проницаемость для Na+ возрастает быстрее, чем для Сl-; вторая (фаза постепенного неспецифического увеличения, проницаемости) - добавление Ca2+ способствует восстановлению ее величины - и третья (необратимая) - добавление Ca2+ уже не вызывает ее увеличения. Удаление двухвалентных катионов не изменяет указанной последовательности коэффициентов проницаемости щелочных катионов, но уменьшает их соотношение, свидетельствуя о дополнительной гидратации пути проницаемости. Параллельно с увеличением ионной проницаемости падает сцепленность клеток. Добавление Ca2+ восстанавливает ее.
Все. щелочноземельные катионы способны восстанавливать проницаемость. Но Be2+ и Mg2+ эффективнее Ca2+ в ряду Be2+>Mg2+>Ca2+>Sr2+>Ba2+. Более специфично взаимодействие бивалентных катионов с эпителием кожи лягушки. Ca2+ оказывал влияние на обратимое восстановление начального уровня проницаемости, а Mg2+ и Sr2+ не проявили активности. Получаемые при сравнительных исследованиях эффективности действия различных катионов данные о селективности могут характеризовать различные типы кислотных центров, являющихся мишенями для этих катионов. Для щелочноземельных катионов предсказано 7 рядов из 24 возможных. Последовательность I ряда представляет собой порядок подвижностей ионов в свободном растворе и соответствует слабым кислотным центрам, энергия гидратации определяет обмен. Последовательность VII, в которой преобладает ион с наименьшим радиусом, т. е. с наибольшей электронной плотностью, реализуется на сильных кислотных центрах, когда энергия взаимодействия ион-кислотного центра больше энергии гидратации. В этом случае кислотный центр обладает достаточной силой поля, чтобы выделять катионы из гидратирующей их водной фазы.
Действие двухвалентных катионов на экстраклеточную проницаемость и механические свойства МК при их высоких (>1 ммоль) и низких (<1 ммоль) концентрациях различно. Вероятно, при добавлении к интактному препарату ткани они сорбируются на многочисленной популяции кислотных центров, обладающих слабой силой поля, и остаются свободными при физиологических концентрациях. Об этом же говорит аналогия с действием пониженных рН. Очевидно, эта популяция участвует в адгезии по типу отталкивания. Во втором случае обработка ЭДТА или бескальциевыми растворами удаляет бивалентные катионы, нормально присутствующие на клеточной поверхности, оголяет сильные кислотные центры. По-видимому, эта вторая популяция сильных центров принадлежит к белковым компонентам мембран клеток и участвует в адгезии по типу притяжения.
Об исчезновении межклеточной связи свидетельствует нарушение организации белковых субъединиц в зоне щелевого соединения. Очевидно, в этом случае бивалентные катионы также оказываются связанными с белковыми компонентами. Анализ различных форм связывания Са2+ с клеточной поверхностью выявляет не менее трех вариантов (А. Г. Меликянц, 1976). Влияние избыточных концентраций Ca2+ в среде на структуры МК изучено мало. Не исследован вопрос о том, какова роль Ca2+ в формировании специализированных структур контактов в процессах гистогенеза.
Увеличение внутриклеточной концентрации Ca++ при внутри-клеточной инъекции или аппликации кальциевых ионофоров вызывает нарушение межклеточной связи. Выраженность эффекта зависит от внутриклеточной концентрации Ca2+. Полное разобщение клеток наблюдается при концентрации Ca2+ ≥ 5 ⋅ 10-5 моль. Частичное разобщение отмечено при более низких концентрациях. Внутриклеточная инъекция Ca2+ приводит к потере межклеточной связи не только эпителиальными клетками, но и лимфоцитами. Увеличение внутриклеточной концентрации Mg2+, Ba2+ и Sr2+ оказывает тот же эффект. P. V. Quinton, C. W. Philpott (1973) изучали ультраструктуру клеточной поверхности и МК эпителиальных клеток желчного пузыря кроликов в условиях связывания анионных групп клеточной поверхности катионными полимерами. Они обнаружили, что при инкубации ткани в растворе полимера уменьшается ширина межмембранных пространств, появляются инвагинации из сливающихся мембран в апикальных участках клеточной поверхности. Области слияния мембран на апикальных и латеральных поверхностях клеток образуют пятислойные структуры, подобные плотным соединениям. Наиболее выражен эффект у поликатионов с большим положительным зарядом.
Большинство экспериментов, посвященных изучению роли Ca2+ в функциях контактов, проводилось в условиях изоляции исследуемой структуры от организма. Однако установленные в опытах на автономных тканевых системах закономерности нельзя, по-видимому, полностью экстраполировать на процессы, происходящие в организме высших животных, имеющих сложный аппарат физиологической регуляции функций МК. В. И. Архипенко и соавторы (1974) вызывали гиперкальциемию у крыс внутривенным введением раствора кальция глюконата и обнаружили, что с повышением содержания Ca2+ в крови увеличивается сцепленность гепатоцитов. Это может свидетельствовать о том, что на клеточной поверхности имеются резервные рецепторные элементы для Ca2+. С. В. Cauldwell и соавторы (1973) установили, что фактор агрегации морских губок в условиях физиологической концентрации Ca2+ в среде имеет 1000-1300 участков связывания ионов Ca2+ на каждую молекулу. С увеличением концентрации Ca2+ выявляются дополнительные участки его связывания. Согласно данным J. J. Deman и соавторов (1974), клеточная поверхность эритроцитов способна дополнительно связывать Ca2+ при высокой концентрации этих ионов в среде, но количество дополнительных рецепторов для Ca2+ в клеточной поверхности, вероятно, ограничено.
В. И. Архипенко и соавторы (1974) исследовали ультраструктуру контактов гепатоцитов через 1,5 ч после введения кальция глюконата. Именно в этот срок выявлено самое значительное увеличение сцепленности гепатоцитов. Структуры контактов не изменены, гиалоплазма и органеллы сохраняют нормальное строение. Повышение концентрации Ca2+ в крови в этом эксперименте было относительно небольшим, не вызывавшим расстройства жизненно важных функций. Очевидно, при таких колебаниях Ca2+ в жидкостных средах изменяется только молекулярный уровень организации контактов (рис. 33). Возвращение к нормокальциемии после временного повышения содержания Ca2+ в крови не сопровождалось восстановлением сцепленности до уровня контроля. На протяжении большого количества времени (с 45-й до 180-й минуты опыта) величина сцепленности достоверно превышала исходный уровень. Можно предположить, что при гиперкальциемии создаются устойчивые конформационные изменения клеточной поверхности и межклеточного вещества, способные существовать продолжительное время после нормализации уровня Ca2+ в крови.
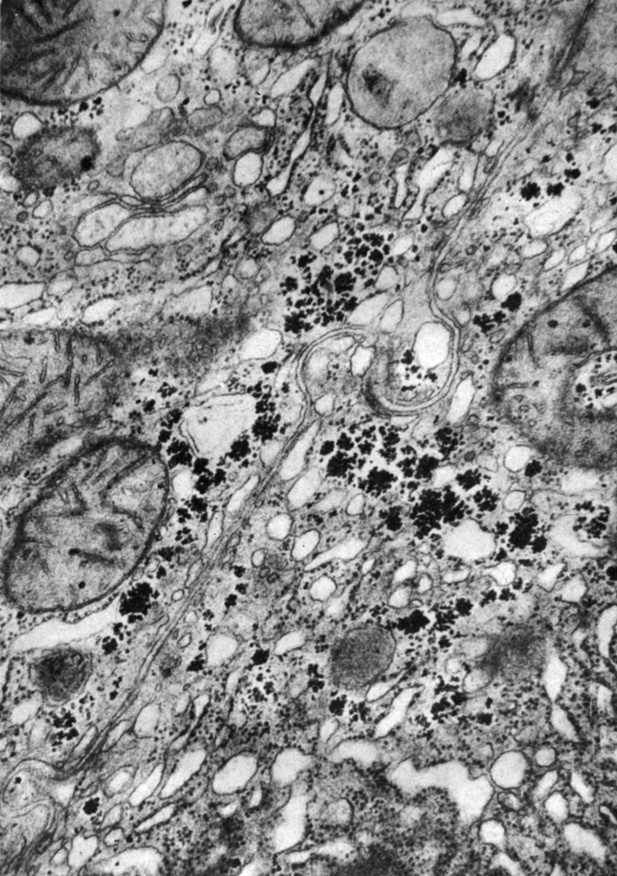
Рис. 33. МК гепатоцита после введения глюконата кальция. Увеличение 33 000
Показатель устойчивости клеточной поверхности не изменился через 10 и 20 мин после введения препарата, когда особенно высок уровень Ca2+ в крови, и достоверно увеличился к 45-й минуте. Через 1,5 ч после инъекции он оставался повышенным, а через 2 ч не отличался от контроля. Таким образом, показатель устойчивости клеточной поверхности при гиперкальциемии увеличивался значительно позже, чем величина сцепленности гепатоцитов. Исходя из этого можно полагать, что за механическую прочность клеточной поверхности ответственны более глубоко расположенные комплексы Ca2+ с компонентами мембран. Количество этих комплексов, возможно, возрастает только тогда, когда происходит полное насыщение Ca2+ более поверхностно расположенных соединений, например вещества цемента.
Гипокальциемические состояния для изучения структуры и функции МК моделировали с помощью введения животным ЭДТА, ТКТ, актиномицина и удаления комплекса щитовидной и околощитовидной желез. При введении ЭДТА крысам одновременно с гипокальциемией отмечено уменьшение величины сцепленности гепатоцитов. Содержание Ca2+ в крови нормализовалось через 45 мин после инъекции, а величина сцепленности - только к 90-й минуте. По-видимому, это время необходимо для восстановления комплексов Ca2+ и компонентами клеточной поверхности и межклеточного вещества.
В опытах с введением кальция глюконата величина сцепленности гепатоцитов достигала уровня контроля значительно медленнее, чем в опытах с введением ЭДТА. Можно предположить, что возвращение к нормальной конформации веществ клеточной поверхности и межклеточного цемента, ответственных за адгезию из Ca-ассоциированного состояния, осуществляется медленнее, чем из Ca-диссоциированного.
Гипокальциемия, индуцированная ТКТ, сопровождалась уменьшением величины сцепленности гепатоцитов. Об этом свидетельствовали выявленные электронномикроскопически участки расширения межмембранного пространства в области простого соединения гепатоцитов. В экспериментах с удалением комплекса щитовидной и околощитовидной желез гипокальциемии также сопутствовали уменьшение величины сцепленности и локальные расширения межмембранного пространства в области простого соединения гепатоцитов. Как уже было отмечено, гипокальциемия, вызванная введением крысам актиномицина, сопровождалась снижением адгезии и нарушением ультраструктуры контактов. Следовательно, при гипокальциемических состояниях разного генеза были обнаружены однотипные изменения: уменьшение величины сцепленности и нарушение структуры контактов гепатоцитов.
Таким образом, зависимость величины адгезии клеток от концентрации Ca2+ в окружающей среде, установленная в опытах in vitro, наблюдается и в условиях целостного организма.
С изменением концентрации Ca2+ на 17-15% в условиях in vivo значительно изменяется сцепленность, тогда как в условиях in vitro для этого необходимы большие сдвиги уровня Ca2+. Возможно, частично это объясняется тем, что в данных исследованиях определялось количество общего Ca сыворотки, а не ионизированного. А физиологически активным является именно Ca2+, и не существует корреляции между ионизированным и общим Са сыворотки. Концентрация ионизированного Ca в значительной степени зависит от рН сыворотки. Действие рН проявляется мгновенно, полностью обратимо и может изменять концентрацию Ca2+ в пределах 100% в диапазоне рН 6,8-7,6. Другим регулятором содержания Ca2+ может служить гепарин.
Вопрос о роли Ca2+ в механизме межклеточной адгезии до сих пор остается спорным. Допускают, что его участие в адгезии заключается в образовании мостиков из двухвалентных ионов между анионными центрами связывания на поверхности контактирующих клеток. Предполагается, что высокая адгезивность поверхности однотипных клеток обусловлена существованием на них анионных групп, расположенных на одинаковых расстояниях, в то время как клетки разных типов имеют наборы анионных групп, находящиеся одни от других на разных расстояниях.
Поэтому Ca2+ связывает только небольшое количество анионов, случайно оказавшихся друг против друга на противоположных поверхностях. Адгезия здесь значительно меньше, чем в первом случае. Такое взаимодействие возможно лишь при расстоянии между клетками не более 1 нм, т. е. только в области плотного соединения. Морфологическим критерием участия Ca2+ в под-держании межклеточного сцепления локальными структурами плотных контактов могло быть разрушение их при удалении Ca2+.
Аналогичным образом Ca2+ может связывать клеточные поверхности с межклеточным веществом (A. S. G. Curtis, 1967). Такая связь наиболее вероятна в области простого соединения. Ca2+ образует плохо растворимые соли со многими органическими и неорганическими анионами, имеющимися на клеточной поверхности и, возможно, в межклеточном цементе. Не исключено, что он может стабилизировать клеточную поверхность, соединяясь с анионами в тангенциальной плоскости и радиарно в пределах поверхности одной клетки. Связывание Ca2+ хелатными агентами значительно увеличивает деформабильность клеточной поверхности. Это показано L. Weiss (1967) на клетках асцитной мышиной саркомы 37. Л. В. Ольшевская, Е. А. Модянова (1971) наблюдали появление микровыростов на клеточных поверхностях гепатоцитов, разобщенных при перфузии бескальциевым раствором. Увеличение деформабильности может быть следствием повреждения всех трех компонентов клеточной поверхности. При изменении структуры подмембранного компонента может нарушаться цитоскелет. При этом изменяются адгезивные свойства клеточной поверхности. Увеличение внутриклеточной концентрации Ca2+ вызывает резкие деструктивные изменения компонентов цитоскелета, участие которых в формировании и поддержании структур МК только начинает проясняться (J. М. Vasiliev, 1977).
Другим возможным способом влияния Ca2+ на межклеточную адгезию является снижение электростатического заряда поверхности (A. S. G. Curtis, 1967). В обычных условиях клеточная поверхность заряжена отрицательно. Любое взаимодействие Ca2+ с ней приводит к отталкиванию между ними. C. Hallman, J. M. Wrigglesworth (1973) предполагают, что Ca2+ может связываться с анионными центрами клеточной поверхности, освобождая катионные группы, и ослаблять электростатическое взаимодействие между заряженными группами на поверхности мембраны.
Изменение рН влияет на все три группы параметров, характеризующих состояние МК. Однако большая часть имеющихся данных касается свойств МК эпителиальных пластов. Из того факта, что катионная проницаемость всех "проницаемых" эпителиев выше анионной, следует признание существования отрицательно заряженных кислотных центров на поверхности клеточных мембран в области зоны замыкания (E. L. Boulpaep, 1974). Понижение рН приводит к уменьшению селективности. Так, на препаратах желчного пузыря кролика относительная проницаемость PNa/PCl и РNa/РK изменялась от 2,7 и 0,7 при рН 7,4 до 1,55 и 0,82 при рН 4,1. Проводимость ткани также уменьшалась на 36-47%.
Более подробные данные получены при исследовании эпителия тонкой кишки крыс. При физиологических значениях рН 7,4 проницаемость щелочных катионов убывала в рядах Cs2>RB+>К+>Na+>Li+ или К+≥RB+>Cs+>Na+>Li+, соответствующих I и IV последовательностям Эйзенмана. Однако в области рН 2,8 обнаружена только первая последовательность, причем отношения ионных проницаемостей также приближались к значениям отношений их подвижностей в водных растворах (A. G. Malenkov, A. G. Melikjants, 1977). Изоэлектрическая точка участка мембраны в области зоны замыкания, определенная методом диффузионного потенциала, наблюдалась при рН 3,1 для желчного пузыря кролика (Е. М. Wright, J. M. Diamond, 1968), рН 2,8 для подвздошной и рН 2,37 для двенадцатиперстной кишки крысы (А. Г. Меликянц, В. Б. Батоев, 1978). При дальнейшем понижении рН эти эпителии становились анионселективными, т. е. происходила перезарядка поверхности мембраны.
Анализ результатов указывает на существование зарядов обоих знаков в области клеточного контакта. Возможная природа этих центров - карбоксильные или фосфатные группы. Отрицательные заряды этих групп, по-видимому, нейтрализуются при низких значениях рН. Увеличение проницаемости Cl предположительно обусловлено протонированием аминов
Зависимость сопротивления эпителия тонкой кишки от величины рН также имеет нелинейный характер. В области рН от 6 до 3 наблюдается увеличение сопротивления, при дальнейшем положении рН оно уменьшается. Таким образом, значение рН 3 и в этом случае оказывается экстремальным. Однако при снижении рН, протонировании кислотных центров и, следовательно, уменьшении их эффективного заряда проводимость ткани должна возрастать. Противоположные результаты указывают на существование дополнительного эффекта. Таким эффектом могло быть уменьшение эффективного сечения зоны замыкания вследствие снижения отталкивания двух смежных контактирующих мембран. Вероятно, увеличение сопротивления, вызванное уменьшением эффективного сечения пути проникновения ионов, компенсирует его с избытком вследствие снижения анионного поля в зоне замыкания. Об уменьшении расстояния между контактирующими мембранами, возможно, свидетельствует также снижение проницаемости неэлектролитов.
рН-зависимость сцепленности клеток аналогична относительной проницаемости PNa/PCl. Сдвиг рН ниже 6 приводит к повышению сцепленности, достигающей максимальной величины при рН 3. Дальнейшее снижение рН уменьшает сцепленность. Таким образом, максимальная сцепленность наблюдается при значении рН, соответствующем изоэлектрической точке клеточных мембран в области зоны замыкания. Это указывает на участие кислотных центров, контролирующих проникновение ионов через МК, во взаимодействии мембран по типу отталкивания. Тогда перезарядка поверхности при рН 3 должна приводить к уменьшению сцепленности, что и отмечается (A. G. Malenkov, A. G. Melikjants, 1977). Увеличение сцепленности клеток при снижении рН обнаружено также в ткани печени (В. И. Левенталь, Г. А. Чуич, 1976).
Изоэлектрическая точка клеточной поверхности изолированных клеток определяется при рН 4,5-6 (G. W. Scherbet, M. S. Lakshmi, 1973). Возможно, это несоответствие указывает на перестройку клеточной мембраны при клеточном разобщении. Смещение изоэлектрической точки в сторону кислых рН (2,8-3,4) наблюдалось в начальной стадии клеточного разобщения при инкубации ткани тонкой кишки в присутствии хелатного агента Na2H2 ЭДТА (А. Г. Меликянц, 1976).
Сдвиг рН наружного раствора в щелочную сторону (до рН 10) нарушает также связь между клетками (W. R. Loewenstein, 1970). Этот эффект, однако, может быть следствием повреждения ткани. При сдвиге рН выше 9 клетки повреждаются быстро и необратимо. Получаемые в этих условиях данные уже нельзя относить к нативному состоянию МК. Напротив, сдвиг рН до 2,5 является обратимым, если инкубация ткани не превышает 2-3 мин (А. Г. Меликянц, В. Б. Батоев, 1978; E. M. Wright, J. M. Diamond, 1968).
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'