
Полупроводниковые полимерные носители на основе комплексных солей тетрацианохинодиметана
Одна из наиболее сложных проблем биоэлектрокатализа - перенос электрона между электродом и активным центром фермента. Очевидно, что в общем случае прямой электронный транспорт требует достаточно строгой ориентации активного центра фермента относительно электрода с созданием наименьшего (или оптимального) расстояния для переноса электрона. В этом плане интерес представляет разработка носителей, обладающих свойствами водопроницаемых гелей и высокой электронной проводимостью. Включение окислительно-восстановительных ферментов в такого рода полимеры должно автоматически приводить к возникновению необходимых для прямого электронного транспорта статистически возникающих структурных соответствий [250, 545, 560].
Предложенный способ получения иммобилизованных ферментов заключается в соосаждении полкатионов с ферментами под действием полувосстановленной соли TCNQ [250]. Фермент иммобилизуется в водопроницаемые полимеры с высокой электропроводностью (вплоть до 10-2 Ом-1⋅см-1, см. рис. 63). Емкость носителей до 500 мг белка на грамм носителя. В качестве поликатионов были использованы следующие полимеры:
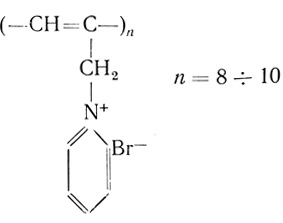 (4.20)
(4.20)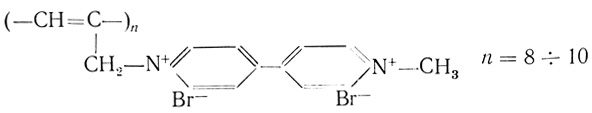 (4.21)
(4.21)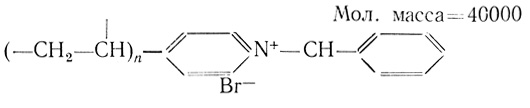 (4.22)
(4.22)В случае (4.21) катионом служит метилвиологен, детально исследованный медиатор электронного транспорта (см. ниже).
Использование полимеров на основе комплексных солей TCNQ позволяет осуществить прямой перенос электрона между электропроводящей матрицей и активным центром фермента. Это показано в работах [250, 545], в которых изучена кинетика выделения водорода с помощью гидрогеназы, иммобилизованной в комплексе полипропаргилпиридиний бромид - TCNQ (электросинтез водорода). В специальной электрохимической ячейке, допускающей отбор проб для газового хроматографического анализа, исследовалась скорость образования водорода при поляризации пирографитового электрода. Как следует из рис. 67, образование водорода происходит только в присутствии гидрогеназы, иммобилизованной в полупроводниковую матрицу. Электронный транспорт в этом случае можно представить в виде
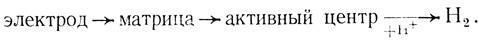 (4.23)
(4.23)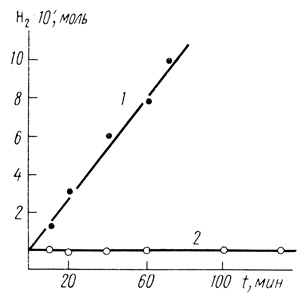
Рис. 67. Кинетические кривые электрохимического образования водорода на полимерном суспензионном электроде: 1 - в качестве суспензии иммобилизованная в гель комплекса полипропаргилпиридиния-TCNQ гидрогеназа; 2 - в качестве суспензии комплекс поли-1-пропаргилпиридин-TCNQ; фосфатный буфер μ = 1,0 М; pH 7,8; 25°
Интересно отметить, что гидрогеназа, иммобилизованная в полупроводник, обладает более высокой специфической активностью. На рис. 68 и 69 приведены данные по исследованию зависимостей скорости образования водорода из восстановленного метилвиологена от концентрации субстрата для гидрогеназы Thiocapsa roseopersicina в матрице полипропаргилпиридилбромида и полипропаргил-(1'-метил-4,4'-дипиридил) бромида. Видно, что максимальные скорости при заданной концентрации фермента в реакциях с иммобилизованным ферментом намного выше. Кроме того, иммобилизация гидрогеназы существенно стабилизирует фермент (рис. 70).
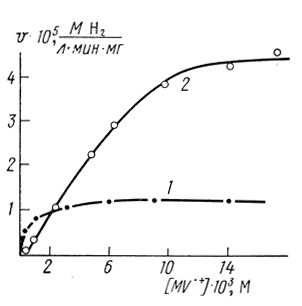
Рис. 68. Зависимость скорости образования водорода гидрогеназой Т. roseopersicina от концентрации субстрата: 1 - исходный фермент; 2 - фермент, иммобилизованный в матрицу полипропаргидрипиридина-TCNQ; pH 7,8, 30°С, 0,35 М фосфата калия
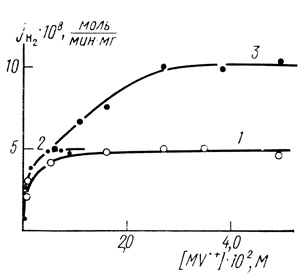
Рис. 69. Зависимость потоков образования водорода гидрогеназой Т. roseopersicina от концентрации субстрата: 1 - исходный фермент в растворе; 2 - исходный фермент в растворе, в качестве субстрата восстановленный полимер поли-γ-метилпиридинпропаргила; 3 - фермент, иммобилизованный в комплекс поли-γ-метилдипиридинпропаргила-TCNQ; 30°С; pH 7,8; 0,35 М фосфата калия
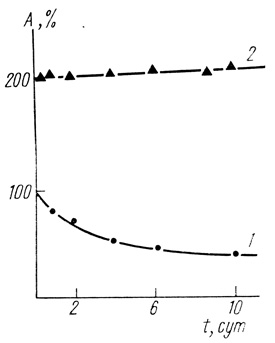
Рис. 70. Стабилизация гидрогеназы Т. roseopersicina на воздухе иммобилизацией в комплекс полипропаргил (γ, γ'-метил) дипиридила-TCNQ; 1 - нативный; 2 - иммобилизованный фермент, 30°С
В результате проведенного исследования носителей на основе комплексных солей TCNQ выявилась возможность безмедиаторного электронного транспорта между ферментом и электропроводящей матрицей. Можно думать, что такого рода носители найдут широкое применение при разработке электрокатализаторов на основе иммобилизованных ферментов.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'