
4. Ферментативное электрохимическое окисление водорода
Водородные электроды, осуществляющие реакцию электрохимической ионизации водорода, являлись модельными системами, на основе исследования которых был создан идейный базис современной теоретической электрохимии. Водородные электроды в настоящее время достаточно интересны как в теоретическом, так и в прикладном плане. В качестве катализатора в большинстве случаев используют металлическую платину или другие металлы VIII группы. Ниже анализируются свойства системы, в которой катализатором ионизации и образования водорода является гидрогеназа.
Данный раздел иллюстрирует эффекты электрокатализа гидрогеназой процессов электрохимического окисления водорода. При этом использовался медиаторный механизм переноса электронов между электродом и активным центром фермента.
Кинетические закономерности действия и механизмы катализа бактериальными гидрогеназами детально анализируются в главе II, из данных которой следует, что эффективными субстратами гидрогеназ являются производные γ, γ'-дипиридина. Гидрогеназа ускоряет процесс установления равновесия в системе метилвиологен-водород
Mv2+ + 1/2H2 ←→ Mv+ + Н+. (4.24)
Нами обнаружено, что восстановленная форма метилвиологена - высокореакционноспособная частица, электрохимически активная на электродах из различных материалов.
Как следует из полярографических данных, метилвиологен способен акцептировать один и два электрона [334, 530]:
Mv2+ + e- → Mv+; (4.25)
Mv+ + е- → Мv0. (4.26)
На рис. 71 приведены поляризационные кривые восстановления метилвиологена на электродах из различных материалов. Видно, что потенциалы полуволн восстановления медиатора не зависят от природы материала электрода. При этом нормальный окислительно-восстановительный потенциал пары Mv2+/Mv+ равен 0,011 В, т. е. весьма близок к окислительно-восстановительному потенциалу водородного электрода.
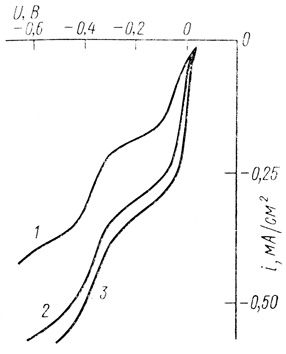
Рис. 71. Поляризационные кривые восстановления метилвиологена на амальгамированном золотом электроде (1) и пирографитовом электроде (2), метилвиологендийодид; (3) метилвиологендихлорид pH 7,2; 0,1 М хлорида калия С; 0,06 М фосфата натрия
Электрохимическое поведение метилвиологена на угольных электродах полностью обратимо, т. е. можно наблюдать как электрохимическое восстановление медиатора, так и окисление его восстановленной формы (рис. 72).
![Рис. 72. Анодные и катодные поляризационные кривые метилвиологена на пирографитовом электроде при концентрации 1 мМ (1 и 1') и 5 мМ (2 и 2'); pH 7,2; 25°С; 0,1 М хлорида калия, 0,06 М фосфата натрия; скорость вращения дискового электрода 600 об/мин [530]](pic/000324.jpg)
Рис. 72. Анодные и катодные поляризационные кривые метилвиологена на пирографитовом электроде при концентрации 1 мМ (1 и 1') и 5 мМ (2 и 2'); pH 7,2; 25°С; 0,1 М хлорида калия, 0,06 М фосфата натрия; скорость вращения дискового электрода 600 об/мин [530]
Кинетика электрохимических реакций восстановления и окисления метилвиологена достаточно хорошо описывается уравнением идеально поляризуемого электрода (рис. 73). Это указывает на то, что в условиях эксперимента редокс реакции метилвиологена протекают в диффузионно контролируемом режиме.
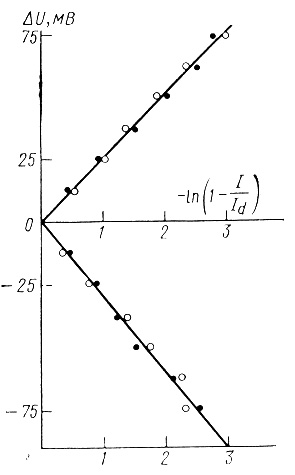
Рис. 73. Линеаризация данных, приведенных на рис. 72 в координатах уравнения идеального поляризуемого электрода
Данный вывод был подтвержден исследованием системы метилвиологен - пирографитовый электрод на вращающемся дисковом электроде. В соответствии с анализом, данным в работе [529], величина тока, определяемого диффузией реагента, дается уравнением
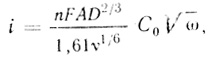 (4.27)
(4.27)т. е. должна наблюдаться линейная зависимость между величиной тока и √ω. На рис. 74 приведены экспериментальные данные по зависимости предельных анодных токов от скорости вращения электрода. Видно, что во всем диапазоне исследованных скоростей метилвиологен окисляется в диффузионно контролируемом режиме.
Таким образом, метилвиологен идеально соответствует требованиям к медиаторам электронного транспорта в электрохимических ферментативных системах: 1) метилвиологен - специфический субстрат гидрогеназы; 2) редокс потенциал пары Mv2+/Mv+ близок к редокс потенциалу водородного электрода; 3) электрохимическая реакция метилвиологена весьма быстрая, так что весь процесс определяется диффузией реагента.
![Рис. 74. Предельные анодные токи электроокисления метилвиогена, восстановленного водородом в присутствии гидрогеназы от скорости вращения дискового электрода при различных концентрациях гидрогеназы: 1 - специфическая активность фермента 0,41 мм3 Н2/см3-мин; 2 - специфическая активность 1,94 мм3 Н2/см3-мин; pH 7,2; 0,01 М хлорида калия; 0,06 М фосфата калия; 25°С [531]](pic/000327.jpg)
Рис. 74. Предельные анодные токи электроокисления метилвиогена, восстановленного водородом в присутствии гидрогеназы от скорости вращения дискового электрода при различных концентрациях гидрогеназы: 1 - специфическая активность фермента 0,41 мм3 Н2/см3⋅мин; 2 - специфическая активность 1,94 мм3 Н2/см3⋅мин; pH 7,2; 0,01 М хлорида калия; 0,06 М фосфата калия; 25°С [531]
Схему процесса ионизации водорода в системе метилвиологен - гидрогеназа - пирографитовый электрод можно представить в виде:
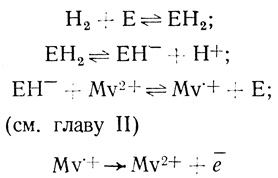 (4.28)
(4.28)Электродная реакция
Экспериментально обнаружено, что предельные анодные токи в системе водород - гидрогеназа - метилвиологен зависят от концентрации фермента в растворе (рис. 75). Поскольку эти токи имеют диффузионный характер, зависимость от концентрации фермента потребовала специального объяснения. Как следует из анализа, сделанного выше, диффузионно контролируемые электродные процессы не зависят от концентрации катализатора. В работе [530] зависимость предельных токов анодного окисления водорода от концентрации фермента была объяснена тем, что в случае метилвиологена заметно неспецифическое окисление его примесями окислителей, что приводит к образованию стационарного состояния. В этих условиях стационарная концентрация восстановленной формы, которая определяет предельный анодный ток окисления, будет зависеть от концентрации фермента
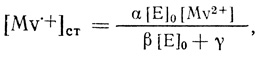 (4.29)
(4.29)где α, β, γ - коэффициенты в кинетических уравнениях ферментативного восстановления, окисления и неспецифического окисления восстановленной формы медиатора следами кислорода.
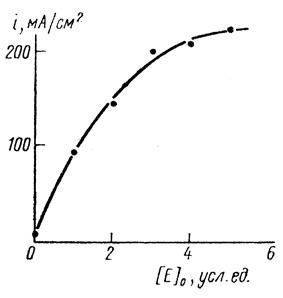
Рис. 75. Зависимость предельных анодных токов в системе водород - гидрогеназа - метилвиологен - пирографитовый электрод от концентрации фермента; pH 7,2; 0,1 М хлорида калия; 0,06 М фосфата натрия; 25°С; 8 мМ метилвиологена, скорость вращения электрода 800 об/мин
Из рисунка 75 видно, что при высоких концентрациях фермента процесс переходит в чисто диффузионный режим, в котором скорость реакции не зависит от концентрации катализатора. По порядку величины токи, снимаемые с гладкого электрода, каковым является пирографит, соответствуют величине, которая следует из рассмотрения кинетической модели биоэлектрокатализа.
Существенным резервом повышения общей скорости электродного процесса в системах с участием медиаторов является увеличение концентрации медиатора [546, 547]. Экспериментально наблюдаемая зависимость токов окисления водорода на пирографитовом электроде от концентрации метилвиологена приведена на рис. 76.
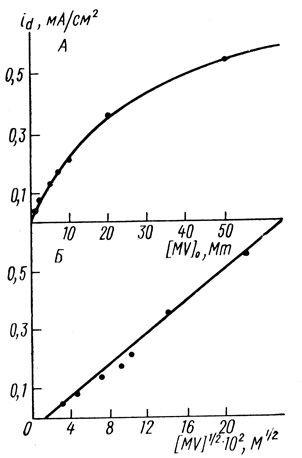
Рис. 76. Зависимость предельных анодных токов в системе водород - гидрогеназа - метилвиологен - пирографитовый электрод от концентрации медиатора; pH 7,2; 0,1 М хлорида калия; 0,06 М фосфата натрия; 25°С; скорость вращения электрода 600 об/мин
Видно, что при высоких концентрациях медиатора наблюдается существенное отклонение предельного тока от линейной зависимости, которую можно было бы ожидать при отсутствии осложняющих явлений.
Для объяснения этого эффекта мы использовали известный из литературы факт образования димерных форм восстановленного метилвиологена при высоких концентрациях
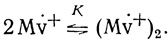 (4.30)
(4.30)В этих условиях при K << [Mv+ должна наблюдаться линейная зависимость предельных анодных токов от корня квадратного из концентрации восстановленной формы медиатора
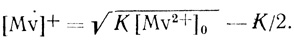 (4.31)
(4.31)Из рисунка 76 следует, что такого рода зависимость действительно имеет место. При этом константа равновесия димеризации (2±1,5)⋅10-3 М находится в хорошем соответствии со значением, найденным ранее [458] спектрофотометрически по отклонению от Закона Ламберта-Веера.
Продемонстрирована принципиальная возможность создания пористых газодиффузионных ферментативных электродов.
Гидрогеназы адсорбционно иммобилизовали на саже ПМ-100 удельной поверхности 100 м2/г. При использовании различного рода связующих из полученного препарата иммобилизованного фермента может быть сформован электрод. На рис. 77 приведены данные по исследованию полученных электродов методом вращающегося диска. При высоких скоростях вращения дискового электрода реакция переходит в кинетический режим, величина тока в котором определяется скоростью ферментативной реакции (плато на зависимости i от √ω). Величина тока, снимаемого с электрода, линейно зависит от количества катализатора в электроде. Каталитическая эффективность действия фермента η (см. уравнение 4.11) близка к единице.
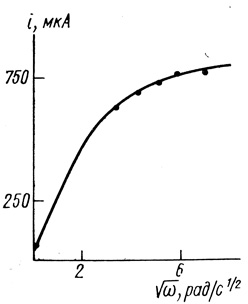
Рис. 77. Зависимость тока от скорости вращения дискового электрода из сажи с иммобилизованной гидрогеназой (17,5 мг сажи с ферментом), концентрация метилвиологена 3 мМ; pH 7,2; 0,1 М хлорида калия; 0,06 М фосфата натрия
Как известно, угольные электроды инертны в электрохимической реакции окисления водорода. Процесс ионизации водорода на угольных электродах протекает с большим перенапряжением. В нашей работе исследование системы водород - гидрогеназа - медиатор - угольный электрод показало, что в этой системе удается осуществить окисление молекулярного водорода в условиях, близких к обратимым.
В отличие от обычных газовых водородных электродов специфической особенностью обсуждаемой системы является возможность широкой вариации электрокаталитических параметров путем изменения концентрации фермента и медиатора.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'