
5.1.1. Элементы, содержащиеся в живых организмах
В земной коре встречается около 100 химических элементов, но для жизни необходимы только 16 из них (табл. 5.1). Наиболее распространены в живых организмах (в порядке убывающего числа атомов) четыре элемента: водород, углерод, кислород и азот. На их долю приходится более 99% как массы, так и числа атомов, входящих в состав всех живых организмов. Однако в земной коре первые четыре места по распространенности занимают кислород, кремний, алюминий и натрий. Биологическое значение водорода, кислорода, азота и углерода связано в основном с их валентностью, равной соответственно 1, 2, 3 и 4, а также с их способностью образовывать более прочные ковалентные связи, нежели связи, образуемые другими элементами той же валентности (см. приложение П.1.1.3).

Таблица 5.1. Элементы, встречающиеся в живых организмах1)
Значение углерода
Углерод имеет ряд уникальных химических свойств, фундаментальных для жизни. Изучением углерода и его соединений занимается отдельная отрасль химии - органическая химия. В чем заключаются эти уникальные свойства углерода? Его атомный номер равен 6, потому что в его ядре содержится шесть протонов, а вокруг ядра обращается шесть электронов (рис. П.1.1). Ядро содержит еще и шесть нейтронов, так что атомная масса углерода равна 12. Вступая в химическую реакцию, углерод приобретает заполненную (стабильную) оболочку из восьми электронов путем обобществления четырех электронов. Он, следовательно, образует ковалентные связи (обобществляет электроны), и валентность его равна 4 (он обобществляет четыре электрона). Простой пример такого обобществления электронов показан на рис. П.1.2,Г, где изображен метан, имеющий эмпирическую формулу СН4. Здесь же, на рис. П.1.2, Г, представлена и структурная формула метана.
5.1. На основе прочитанного укажите, в чем заключается различие между эмпирической и структурной формулами.
Когда атом углерода присоединяет к себе четыре каких-нибудь атома или группы, четыре связи располагаются симметрично, образуя тетраэдр (рис. 5.1). Если такое трехмерное расположение атомов существенно, то структурную формулу молекулы можно изображать так, как это показано на рис. 5.1, Б, Другое широко применяемое условное обозначение предписывает исключать из структурной формулы все атомы углерода и все присоединенные к ним водородные атомы. Простейший пример такого обозначения представлен на рис. 5.2, где изображена этановая, или уксусная, кислота. Из рис. 5.2 видно, что эмпирическая формула уксусной кислоты имеет вид СН3СООН.
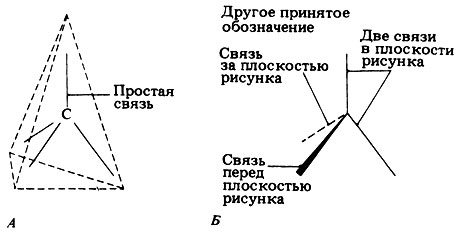
Рис. 5.1. Тетраэдрическое расположение углеродных связей
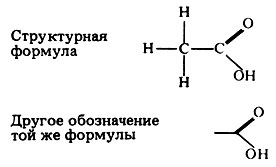
Рис. 5.2. Два способа изображения структурных формул этановой (уксусной) кислоты СН3СООН
Зная валентность углерода (4), нетрудно определить местоположение всех недостающих водородных атомов. Такой способ изображения удобен вдвойне: он упрощает написание структурных формул и позволяет сосредоточить внимание на более важных химических группах.
Значение углерода определяется, как сказано, тем, что он способен образовывать стабильные, прочные ковалентные связи. Эти связи он образует как с другими углеродными атомами, так и с атомами других элементов.
Углерод обладает особенностью, не свойственной (во всяком случае в такой мере) ни одному другому элементу: соединяясь между собой ковалентными связями, его атомы образуют стабильные цепи или кольца (рис. 5.3). Именно этой особенностью углерода и объясняется в первую очередь чрезвычайное разнообразие органических соединений; С-С-связи можно рассматривать как скелет органических молекул.
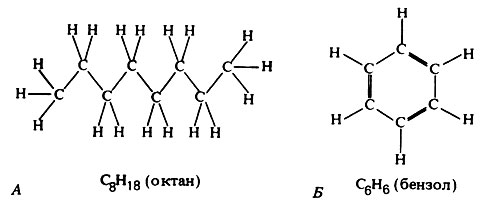
Рис. 5.3. Цепь (А) и кольцо (Б), построенные из атомов углерода путем образования С-С - связей
5.2. Напишите структурные формулы а) октана и б) бензола, руководствуясь рис. 5.2.
Углеродные атомы образуют обычно ковалентные связи с атомами Н, N, О, Р и S. Соединение с этими и с другими элементами в различных комбинациях обеспечивает большое разнообразие органических соединений.
Кратные связи. Еще одно важное свойство углерода заключается в его способности образовывать кратные связи; этим же свойством обладают кислород и фосфор. Известны следующие кратные связи:
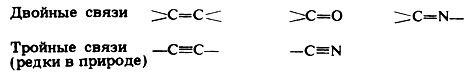
Кратные связи
Соединения, содержащие двойные (=) или тройные (≡) углерод-углеродные связи, называются ненасыщенными. В насыщенном соединении имеются только простые (одинарные) углерод-углеродные связи.
5.3. Напишите структурную формулу ненасыщенного органического соединения этена (этилена) С2Н4.
Суммируем важные химические свойства углерода:
1. Его атомы сравнительно малы и атомная масса невелика.
2. Он способен образовывать четыре прочные ковалентные связи.
3. Он образует углерод-углеродные связи, строя таким путем длинные углеродные скелеты молекул в виде цепей и (или) колец.
4. Он образует кратные ковалентные связи с другими углеродными атомами, а также с кислородом и азотом.
Это уникальное сочетание свойств обеспечивает колоссальное разнообразие органических молекул. Разнообразие проявляется в размерах молекул, определяемых их углеродным скелетом, в химических свойствах, которые зависят от присоединенных к скелету элементов и химических групп, а также от степени насыщенности скелета, и, наконец, в различной форме молекул, определяемой геометрией, т. е. углами связей.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'