
5.1.2. Простые биологические молекулы
Ознакомившись с элементами, присутствующими в живых организмах, обратимся теперь к соединениям, в состав которых эти элементы входят. И здесь мы также обнаруживаем фундаментальное сходство между всеми живыми организмами. Больше всего в организмах содержится воды - от 60 до 95% общей массы организма. Во всех организмах мы находим также и некоторые простые органические соединения, играющие роль "строительных блоков", из которых строятся более крупные молекулы (табл. 5.2). О них речь пойдет ниже.

Таблица 5.2. Химические 'строительные блоки' органических соединений
Таким образом, сравнительно небольшое число видов молекул дает начало всем более крупным молекулам и структурам живых клеток. По мнению биологов, эти немногие виды молекул могли синтезироваться в "первичном бульоне" (т. е. в концентрированном растворе химических веществ) в мировом океане на ранних этапах существования Земли, еще до появления жизни на нашей планете (разд. 24.1). Простые молекулы строятся в свою очередь из еще более простых неорганических молекул, а именно из диоксида углерода, из азота и воды.
Важная роль воды
Без воды жизнь на нашей планете не могла бы существовать. Вода важна для живых организмов вдвойне, ибо она не только необходимый компонент живых клеток, но для многих еще и среда обитания. Нам следует поэтому сказать здесь несколько слов о ее химических и физических свойствах.
Свойства эти довольно необычны и связаны главным образом с малыми размерами молекул воды, с полярностью ее молекул и с их способностью соединяться друг с другом водородными связями. Под полярностью подразумевают неравномерное распределение зарядов в молекуле. У воды один конец молекулы несет небольшой положительный заряд, а другой - отрицательный. Такую молекулу называют диполем. Более электроотрицательный атом кислорода притягивает электроны водородных атомов. В результате между молекулами воды возникает электростатическое взаимодействие, а, поскольку противоположные заряды притягиваются, молекулы как бы склонны "склеиваться" (рис. 5.4). Эти взаимодействия, более слабые, чем обычные ионные связи, называются водородными связями. Учитывая данную особенность воды, мы можем теперь перейти к рассмотрению тех ее свойств, которые важны с биологической точки зрения.
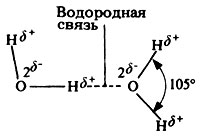
Рис. 5.4. Водородная связь между двумя полярными молекулами воды. δ+ - очень маленький положительный заряд; δ- - очень маленький отрицательный заряд
Биологическое значение воды
Вода как растворитель. Вода - превосходный растворитель для полярных веществ. К ним относятся ионные соединения, такие, как соли, у которых заряженные частицы (ионы) диссоциируют (отделяются друг от друга) в воде, когда вещество растворяется (рис. 5.5), а также некоторые неионные соединения, например сахара и простые спирты, в молекуле которых присутствуют заряженные (полярные) группы (у Сахаров и спиртов это ОН-группы).
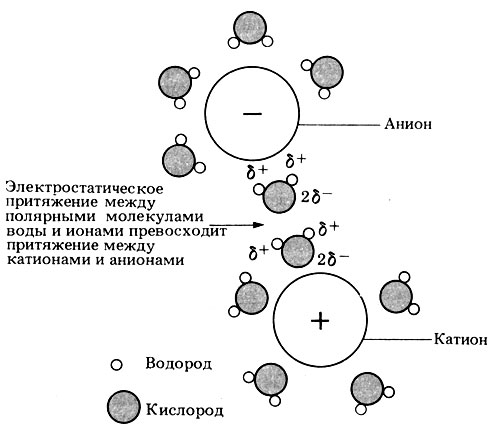
Рис. 5.5. Распределение молекул воды вокруг аниона (-) и катиона (+). Обратите внимание, что более электроотрицательные атомы кислорода молекул воды обращены в сторону катиона, а вокруг аниона они направлены, наоборот, наружу. Это наблюдается, когда ионные соединения растворяются в воде. Вследствие присущей им полярности молекулы воды ослабляют притяжение между ионами противоположного знака, а затем окружают ионы и удерживают их на определенном расстоянии друг от друга. В этих случаях принято говорить, что ионы гидратированы
Когда вещество переходит в раствор, его молекулы или ионы получают возможность двигаться более свободно и соответственно его реакционная способность возрастает. По этой причине в клетке большая часть химических реакций протекает в водных растворах. Неполярные вещества, например липиды, не смешиваются с водой и потому могут разделять водные растворы на отдельные компартменты, подобно тому как их разделяют мембраны. Неполярные части молекул отталкиваются водой и в ее присутствии притягиваются друг к другу, как это бывает, например, когда капельки масла сливаются в более крупные капли; иначе говоря, неполярные молекулы гидрофобны. Подобные гидрофобные взаимодействия играют важную роль в обеспечении стабильности мембран, а также многих белковых молекул, нуклеиновых кислот и других субклеточных структур.
Присущие воде свойства растворителя означают также, что вода служит средой для транспорта различных веществ. Эту роль она выполняет в крови, в лимфатической и экскреторной системах, в пищеварительном тракте и во флоэме и ксилеме растений.
Большая теплоемкость. Удельной теплоемкостью воды называют количество теплоты в джоулях, которое необходимо, чтобы поднять температуру 1 кг воды на 1°С. Вода обладает большой теплоемкостью. Это значит, что существенное увеличение тепловой энергии вызывает лишь сравнительно небольшое повышение ее температуры. Объясняется такое явление тем, что значительная часть этой энергии расходуется на разрыв водородных связей, ограничивающих подвижность молекул воды, т. е. на преодоление ее упомянутой выше "клейкости".
Большая теплоемкость воды сводит к минимуму происходящие в ней температурные изменения. Благодаря этому биохимические процессы протекают в меньшем интервале температур, с более постоянной скоростью и опасность нарушения этих процессов от резких отклонений температуры грозит им не столь сильно. Вода служит для многих клеток и организмов средой обитания, для которой характерно довольно значительное постоянство условий.
Большая теплота испарения. Скрытая теплота испарения (или относительная скрытая теплота испарения) есть мера количества тепловой энергии, которую необходимо сообщить жидкости для ее перехода в пар, т. е. для преодоления сил молекулярного сцепления в жидкости. Испарение воды требует довольно значительных количеств энергии. Это объясняется существованием водородных связей между молекулами воды. Именно в силу этого температура кипения воды - вещества со столь малыми молекулами - необычно высока.
Энергия, необходимая молекулам воды для испарения, черпается из их окружения. Таким образом, испарение сопровождается охлаждением. Это явление используется у животных при потоотделении, при тепловой одышке у млекопитающих или у некоторых рептилий (например, у крокодилов), которые на солнцепеке сидят с открытым ртом; возможно, оно играет заметную роль и в охлаждении транспирирующих листьев.
Большая теплота плавления. Скрытая теплота плавления (или относительная скрытая теплота плавления) есть мера тепловой энергии, необходимой для расплавления твердого вещества (в нашем случае - льда). Воде для плавления (таяния) необходимо сравнительно большое количество энергии. Справедливо и обратное: при замерзании вода должна отдать большое количество тепловой энергии. Это уменьшает вероятность замерзания содержимого клеток и окружающей их жидкости. Кристаллы льда особенно губительны для живого, когда они образуются внутри клеток.
Плотность и поведение воды вблизи точки замерзания. Плотность воды от +4 до 0°С понижается, поэтому лед легче воды и в воде не тонет. Вода- единственное вещество, обладающее в жидком состоянии большей плотностью, чем в твердом.
Поскольку лед плавает в воде, он образуется при замерзании сначала на ее поверхности и лишь под конец в придонных слоях. Если бы замерзание прудов шло в обратном порядке, снизу вверх, то в областях с умеренным или холодным климатом жизнь в пресноводных водоемах вообще не могла бы существовать. Лед покрывает толщу воды, как одеялом, что повышает шансы на выживание у организмов, обитающих в воде. Это важно в условиях холодного климата и в холодное время года, но, несомненно, особенно важную роль это играло в ледниковый период. Находясь на поверхности, лед быстрее и тает. То обстоятельство, что слои воды, температура которых упала ниже 4°С, поднимаются вверх, обусловливает перемешивание воды в больших водоемах. Вместе с водой циркулируют и находящиеся в ней питательные вещества, благодаря чему водоемы заселяются живыми организмами на большую глубину.
Большое поверхностное натяжение и когезия. Когезия - это сцепление молекул физического тела друг с другом под действием сил притяжения. На поверхности жидкости существует поверхностное натяжение - результат действующих между молекулами сил когезии, направленных внутрь. Благодаря поверхностному натяжению жидкость стремится принять такую форму, чтобы площадь ее поверхности была минимальной (в идеале - форму шара). Из всех жидкостей самое большое поверхностное натяжение у воды. Значительная когезия, характерная для молекул воды, играет важную роль в живых клетках, а также при движении воды по сосудам ксилемы в растениях (разд. 14.4). Многие мелкие организмы извлекают для себя пользу из поверхностного натяжения: оно позволяет им удерживаться на воде или скользить по ее поверхности.
Вода как реагент. Биологическое значение воды определяется и тем, что она представляет собой один из необходимых метаболитов, т. е. участвует в метаболических реакциях. Вода используется, например, в качестве источника водорода в процессе фотосинтеза (разд. 9.4.2), а также участвует в реакциях гидролиза.
Вода и процесс эволюции. Роль воды для живых организмов находит свое отражение, в частности, в том факте, что одним из главных факторов естественного отбора, влияющих на видообразование, является недостаток воды. К этой теме мы уже обращались в гл. 3 и 4, когда обсуждали ограничения, с которыми связано распространение некоторых растений, имеющих подвижные гаметы. Все наземные организмы приспособлены к тому, чтобы добывать и сберегать воду; в крайних своих проявлениях - у ксерофитов, у обитающих в пустыне животных и т. п. - такого рода приспособления представляются подлинным чудом "изобретательности" природы. В табл. 5.3 перечислен ряд важных биологических функций воды.
| У всех организмов
Обеспечивает поддержание структуры (высокое содержание воды в протоплазме) Служит растворителем и средой для диффузии Участвует в реакциях гидролиза Служит средой, в которой происходит оплодотворение Обеспечивает распространение семян, гамет и личиночных стадий водных организмов, а также семян некоторых наземных растений, например кокосовой пальмы |
| У растений
Обусловливает осмос и тургесцентность (от которых зависит многое: рост (увеличение клеток), поддержание структуры, движения устьиц и т. д.) Участвует в фотосинтезе Обеспечивает транспирацию, а также транспорт неорганических ионов и органических молекул Обеспечивает прорастание семян - набухание, разрыв семенной кожуры и дальнейшее развитие |
| У животных
Обеспечивает транспорт веществ Обусловливает осморегуляцию Способствует охлаждению тела (потоотделение, тепловая одышка) Служит одним из компонентов смазки, например в суставах Несет опорные функции (гидростатический скелет) Выполняет защитную функцию, например в слезной жидкости и в слизи Способствует миграции (морские течения) |
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'