
П.1.1.1. Строение атома
Все элементы состоят из атомов. Слово "атом" происходит от греческого atomos, что значит "неделимый".
В состав атома входят протоны, нейтроны и электроны (табл. П.1.1). Массы протонов и нейтронов равны и в сумме составляют массу атомного ядра. Масса электронов во много раз меньше, чем масса протонов и нейтронов, поэтому под массой атома подразумевают только массу его ядра.

Таблица П.1.1. Положение в атоме, масса и заряд протонов, нейтронов и электронов
Нейтрон состоит из одного протона и одного электрона, поэтому он электрически нейтрален, т. е. его заряд равен нулю.
Атом электрически нейтрален, потому что число протонов в его ядре равно числу электронов, движущихся вокруг ядра.
Число протонов в ядре атома называется атомным номером данного элемента. Он также равен числу электронов этого атома. Сумма числа протонов и числа нейтронов данного атома называется его массовым числом.
Атомы одного и того же элемента существуют в разных формах, называемых изотопами, которые отличаются друг от друга массовым числом (разд. П.1.3). Атомной массой называют среднюю массу данного атома; обычно под этим понимается средняя величина для природной смеси его изотопов. Хлор, например, представляет собой смесь изотопов с массовыми числами 35 и 37; соотношение этих изотопов таково, что у встречающегося в природе хлора атомная масса равна 35,5.
В настоящее время известно свыше 100 элементов. Их можно расположить в порядке возрастания атомных номеров, как это сделано в табл. П.1.2. Электроны размещаются вокруг ядра, заполняя ряд электронных оболочек (табл. П.1.2). В первой электронной оболочке (ближайшей к ядру и потому наименьшей) могут удерживаться два электрона, во второй - до восьми, в третьей - до 18 и в четвертой - до 32.
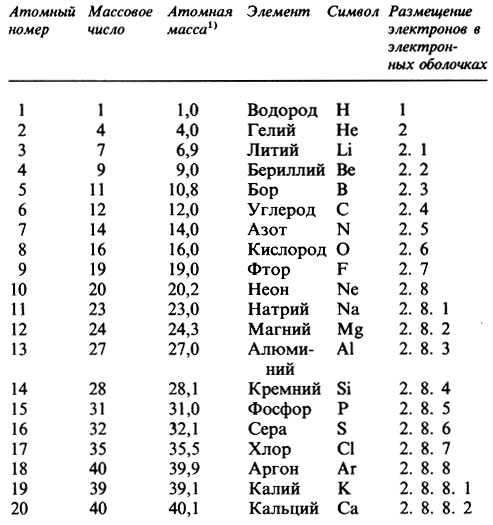
Таблица П.1.2. Первые 20 элементов (в порядке возрастания атомных номеров)
1) (Атомная масса называлась раньше атомным весом. Величины атомных масс даны до первого десятичного знака. Ниже перечислены (в порядке возрастания их атомных номеров) некоторые наиболее известные элементы и указаны их символы: хром (Сr), марганец (Мn), железо (Fe), кобальт (Со), никель (Ni), медь (Сu), цинк (Zn), мышьяк (As), бром (Вr), молибден (Мо), серебро (Ag), кадмий (Cd), qод (I), барий (Ва), платина (Pt), ртуть (Hg), свинец (Рb), радий (Ra), уран (U), плутоний (Рu).)
У более крупных атомов число электронных оболочек больше четырех, но мы здесь о них говорить не будем. На рис. П.1.1 представлено размещение электронов в электронных оболочках первых 12 элементов.
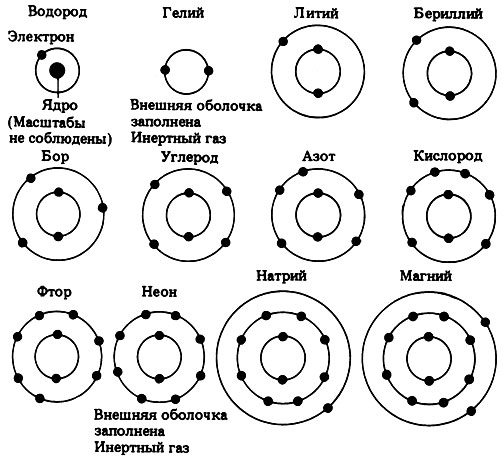
Рис. П.1.1. Размещение электронов в электронных оболочках первых 12 элементов. (Ядро показано только у атома водорода.)
Любой элемент, у которого внешняя электронная оболочка заполнена целиком, практически нереакционноспособен. По этой причине гелий и неон (табл. П.1.2) настолько инертны, что крайне редко вступают в соединение с другими атомами. Поэтому их называют благородными газами.
Все прочие элементы стремятся заполнить свои электронные оболочки, вступая в реакцию с другими элементами. Когда два атома реагируют друг с другом, образуя соединение, между ними может возникнуть либо ионная, либо ковалентная связь.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'