
Опыт 14.2. Определение среднего осмотического давления клеточного сока в препарате растительных клеток методом начинающегося плазмолиза
Осмотическое давление в растительных клетках можно измерять различными методами, но самый удобный из них - это метод начинающегося плазмолиза. Он основан на следующих соотношениях:
(1) ψклетки = ТД - ОД; ψраствора = - ОД;
(2) ψклетки = ψраствора, когда эти две системы находятся в равновесии.
Препараты исследуемой ткани уравновешивают в растворах разной концентрации (с разным водным потенциалом); цель этого - подобрать раствор, который вызывает начинающийся плазмолиз, т. е. заставляет протопласты сморщиваться настолько, что едва-едва начинается отделение протопласта от клеточной стенки. В этот момент тургорное давление равно нулю, поскольку протопласт уже не давит на клеточную стенку, так что ψклетки = - ОДклетки = ψраствора = - ОДраствора [из уравнений (1) и (2), приведенных выше]. Другими словами, осмотическое давление раствора, который вызывает начинающийся плазмолиз, будет таким же, как и у клеточного сока.
На самом деле осмотическое давление в клетках одной и той же ткани сильно варьирует, так что одни клетки плазмолизируются в более разбавленных растворах, чем другие. Считают, что плазмолиз начинается тогда, когда плазмолизируется 50% клеток. В этот момент остальные 50% клеток еще не плазмолизированы, и можно сказать, что "средняя" клетка находится в состоянии начинающегося плазмолиза. Полученная величина отражает среднее значение осмотического давления в ткани.
Материалы и оборудование
Черешок ревеня или луковица
6 чашек Петри
6 пробирок
Штатив для пробирок
Этикетки или восковой карандаш
2 градуированные пипетки на 10 или 25 мл
2 стакана на 100 мл
Тонкая кисточка для рисования
Дистиллированная вода
1 М раствор сахарозы
Тонкий пинцет
Пастеровские пипетки
Предметные и покровные стекла
Микроскоп
Миллиметровка
Бритвенное лезвие или острый скальпель
Методика
(После этого первого метода мы опишем другую методику для свеклы.)
1. Подпишите шесть чашек Петри и шесть пробирок для следующих растворов сахарозы: 0,3; 0,35; 0,4; 0,45; 0,5 и 0,6 М.
2. Возьмите градуированную пипетку на 10 или 25 мл, стакан дистиллированной воды и стакан 1 М раствора сахарозы и приготовьте в пробирках по 20 мл раствора различной концентрации. Объемы, которые нужно взять для этого, указаны в табл. 14.3.

Таблица 14.3. Приготовление разбавленных растворов сахарозы для опыта 14.2
3. Хорошо перемешайте каждый раствор путем встряхивания пробирки. Это очень важно. Вылейте полученные растворы в соответствующие чашки Петри.
4. Лук. Оторвите одну из мясистых чешуй луковицы. Пока внутренний эпидермис еще находится на месте, возьмите лезвие или скальпель и вырежьте в нем 6 квадратиков размером приблизительно 5 x 5 мм. Тонким пинцетом отделите квадратики и сразу же положите их по одному в каждую чашку Петри. Осторожно покачайте чашки, чтобы ткань была полностью погружена и хорошо промылась раствором сахарозы. Оставьте чашки примерно на 20 мин.
Ревень. Прорежьте в наружном эпидермисе 6 квадратиков размером около 5x5 мм, отделите их и т.д., как описано для лука.
5. С помощью кисточки выньте ткань из 0,60 М раствора и перенесите ее на предметное стекло в раствор сахарозы той же концентрации. Накройте покровным стеклом и рассмотрите под микроскопом.
6. При малом увеличении выберите подходящую зону клеток. Затем используйте объектив для среднего или большого увеличения и просмотрите выбранную зону, передвигая стекло. Запишите, в каком состоянии (плазмолизированном или нет) находятся первые 100 просмотренных клеток. Клетку считают плазмолизированной, если протопласт в ней хотя бы чуть-чуть отошел от клеточной стенки.
7. Повторите всю процедуру с остальными квадратиками ткани в соответствующих растворах.
8. Подсчитайте процент плазмолизированных клеток в каждом растворе. Постройте график, отложив по вертикальной оси процент плазмолизированных клеток, а по горизонтальной - молярность раствора сахарозы.
9. По графику определите молярность раствора сахарозы, при котором плазмолизируется 50% клеток.
10. Постройте график зависимости осмотического давления (по вертикальной оси) от молярности раствора сахарозы (по горизонтальной оси) по данным, приведенным в табл. 14.4.
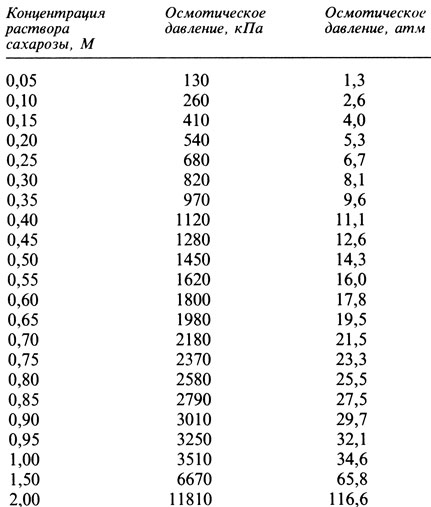
Таблица 14.4. Осмотическое давление растворов сахарозы при 20°С
11. Из полученного графика определите осмотическое давление того раствора, который вызывает 50%-ный плазмолиз. Эта величина будет соответствовать усредненному осмотическому давлению клеточного сока.
Результаты
На рис. 14.5 показана типичная кривая для эпидермиса лука. Сходные результаты получаются и с эпидермисом ревеня.
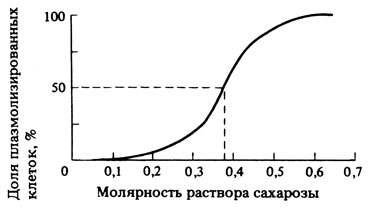
Рис. 14.5. Доля плазмолизированных клеток в эпидермисе лука при разных концентрациях сахарозы в растворе
14.9. Какова величина осмотического давления в клетках эпидермиса лука, если 50% клеток плазмолизируется в 0,38 М растворе сахарозы?
Использование тканей корня свеклы
Корень свеклы - гораздо менее удобный материал; однако, если этот опыт объединить с опытом 14.3, можно будет определить тургорное давление в клетках свеклы, хотя следует подчеркнуть, что у разных корней водный потенциал и осмотическое давление могут быть разными. В обычных условиях осмотическое давление у свеклы выше, чем у лука или ревеня, так как в вакуолях свеклы больше сахара и неорганических солей.
Методику нужно слегка модифицировать: этапы 1-3 те же, что и в опыте с луком и ревенем. Единственное отличие - это концентрации растворов: 0,4; 0,45; 0,5; 0,55; 0,6 и 0,7 М. Затем (4) вырежьте из корня прямоугольный "столбик" квадратного сечения размером примерно 5 x 5 мм. Возьмите лезвие и сделайте тонкие квадратные срезы (не более 0,5 мм толщиной). Чем тоньше будут срезы, тем легче будет подсчитать плазмолизированные клетки. Окрашенный сок облегчает подсчет. Срезы следует сделать перед самым занятием и подержать их в дистиллированной воде. Положите по нескольку срезов в каждый раствор и оставьте их в сахарозе примерно на 30 мин. Тем временем рассмотрите под микроскопом срезы, залитые дистиллированной водой, чтобы познакомиться, как выглядят неплазмолизированные клетки. Скорее всего, срезы будут тоньше с краю, и там их легче рассматривать. Некоторые поврежденные клетки могут оказаться обесцвеченными, а около проводящей ткани иногда будут видны более мелкие клетки; их не надо брать для подсчета. Этапы 5-11 те же, что и в предыдущем опыте; начните с ткани, помещенной в раствор 0,7 М.
Результаты
Серия данных, полученных для свеклы, приведена в табл. 14.5.

Таблица 14.5. Изменение доли плазмолизированных клеток в ткани из корня свеклы при различной концентрации сахароз в растворе
14.10. Каково усредненное осмотическое давление в клетках свеклы, использованных в этом эксперименте? (Чтобы ответить на этот вопрос, вам нужно будет построить график.)
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'