
14.13.2. Миоглобин
Миоглобин широко распространен у животных, но наиболее характерен для скелетных мышц млекопитающих. Он обладает высоким сродством к кислороду, поэтому кривая диссоциации оксимиоглобина значительно сдвинута влево по отношению к кривой для оксигемоглобина (рис. 14.67). Действительно, оксигемоглобин начинает отдавать кислород только после того, как парциальное давление О2 падает ниже 20 мм рт. ст. Благодаря этому он играет в покоящейся мышце роль кислородного депо и отдает О2 только тогда, когда исчерпываются запасы оксигемоглобина. По последовательности аминокислот и третичной структуре молекула миоглобина очень сходна с отдельной субъединицей молекулы гемоглобина. Однако молекулы миоглобина не соединяются между собой с образованием тетрамера и не способны поэтому к положительной кооперативности в связывании кислорода. По-видимому, оба белка происходят от общей предковой молекулы.
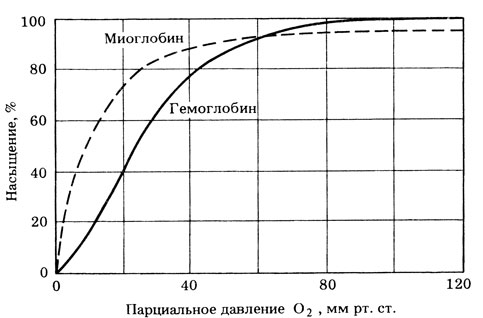
Рис. 14.67. Сравнение кривых диссоциации оксигемоглобина и оксимиоглобина. Миоглобин остается насыщенным О2 на 80% до тех пор, пока парциальное давление кислорода не падает ниже 20 мм рт. ст. Это означает, что миоглобин удерживает кислород в покоящемся мышечном волокне, но отдает его, когда в результате интенсивной мышечной работы используется весь кислород, доставленный гемоглобином
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'