
Миоглобин и гемоглобин
Впервые анализ пространственной структуры белка методом рентгеновской кристаллографии был осуществлен Кендрью и его коллегами для миоглобина кашалота. Наиболее плодотворным подходом для изучения белков оказался метод многократного или однократного изоморфного замещения (см. предыдущий раздел). К сожалению, поиск таких производных не имеет общих рецептов для различных белков. Как указывалось выше, нет пути, позволяющего предсказать, будет ли данное производное изоморфным по отношению к исходному белку.
В 1954 г. Перутц обнаружил, что оксигемоглобин лошади может кристаллизоваться в присутствии n-хлормеркурбензоата или ионов серебра. Таким образом, он был первым, кто обнаружил изоморфное замещение. Несмотря на это, в 50-х годах не было возможности интерпретировать рентгенограммы с помощью плоских проекций, поскольку при проецировании содержимого ячейки с периодом ~60 Å многие атомы перекрываются. Стало очевидно, что в интерпретации рентгенограмм белков весьма существенную роль должен сыграть трехмерный анализ. Однако для установления сложных пространственных структур пришлось ждать появления больших электронно-вычислительных машин. Лишь при помощи этих необыкновенно быстродействующих инструментов стал возможен анализ сотен и даже тысяч рефлексов.
Кендрью и его коллеги применили метод изоморфного замещения для изучения структуры миоглобина, гораздо более простого аналога молекулы гемоглобина. В миоглобин входит 153 аминокислоты и 1 гем, а его молекулярный вес составляет примерно 17000. Применяя метод подбора, Кендрью с сотрудниками получил несколько годных для изучения изоморфных производных миоглобина. Некоторые из них включали производные n-хлормеркурбензолсульфоната, хлористого золота и диаминртути, а также комплекса с йодистой ртутью. Вначале анализ пространственной структуры миоглобина был проведен при разрешении 6 Å*.
* (Разрешение на карте электродной плотности определяется числом членов, используемых в фурье-представлении. Чем это число выше, тем большее число деталей структуры молекулы будет (выявлено. При переходе к более тонкому разрешению очень сильно возрастает число членов разложения и, следовательно, число рефлексов, которые необходимо измерить.)
Такое разрешение давало 400 рефлексов. Используя быстродействующую электронно-вычислительную машину, Кендрью и его сотрудники смогли интерпретировать карту электронной плотности. Проведенный ими анализ позволил установить структуру молекулы в общих чертах, показал, что обширные участки ее имеют форму α-спишли, и позволил продемонстрировать их ориентацию относительно друг друга. Общий вид молекулы, полученный при таком разрешении, представлен на рис. 10.8, а. Осколки, содержащие гем, анализировались методом электронного спинового резонанса, что позволило также получить данные относительно ориентации этой группы. Скоулоуди занималась изучением миоглобина тюленя. Она получила различные изоморфные производные и обнаружила, что при разрешении 6 Å пространственная структура миоглобина тюленя существенно не отличается от миоглобина кашалота, изучавшегося Кендрью и его коллегами.
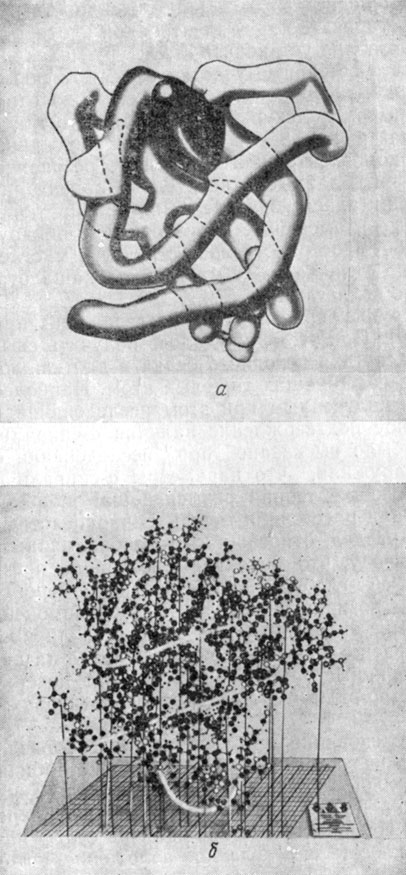
Рис. 10.8. Модель пространственной структуры молекулы миоглобина. а - при разрешении 6 Å видны лишь очертания структуры белка; б - при разрешении 2 Å можно выделить аминокислотные последовательности. Светлые трубочки изображают участки белка, имеющие форму α-спирали
Затем кембриджская группа провела ряд исследований при разрешении 2 Å (рис. 10.8,б). При этом им удалось получить свыше 9000 отчетливых рефлексов для исходного белка и для каждого из четырех производных, содержащих тяжелый атом. Наиболее значительным результатом, полученным при этом исследовании с разрешением 2 Å, было явное подтверждение наличия α-спирали, предположение о которой было высказано при исследовании с разрешением 6 Å. Они обнаружили, что параметры α-спирали в основном имеют соответствующие теории размеры: шаг спирали 5,4 Å, проекция на ось спирали расстояния между аминокислотными остатками - 1,5 Å (см. раздел, относящийся к фибриллярным белкам). Они пришли к выводу, что молекула миоглобина чрезвычайно компактна; что ее глобулярная структура, вероятно, стабилизуется силами, возникающими за счет взаимодействия между близлежащими атомами, а не за счет полярных сил; что полярные группы располагаются преимущественно на периферии молекулы, а неполярные группы - внутри. Все поверхностные полярные группы, по-видимому, сильно сольватированы (рис. 10.8).
Не удивительно, что исследование гемоглобина шло гораздо медленнее в первую очередь из-за того, что молекула гемоглобина по размеру в четыре раза больше миоглобина. Она состоит из двух α- и двух β-цепей. В каждую цепь входит один гем и по крайней мере одна сульфгидрильная группа. Вследствие наличия сульфгидрильных групп у гемоглобина есть определенное положение, которое замещается тяжелым атомом. β-Цепи замещали n-хлормеркурбензоатом, димеркурацетатом и "бета-меркуриалом" (1,4-диацет-оксиртуть-2,3-диметоксибутан). При разрешении 5,5 Å Перутц и его сотрудники получили 1200 рефлексов для каждого из этих производных и для исходного соединения. По этим рентгенограммам они смогли построить молекулу оксигемоглобина в общих чертах. Некоторое время спустя способом, описанным выше, они получили для миоглобина данные об электронной плотности при разрешении 2,8 Å. Как оказалось, молекула оксигемоглобина имеет приблизительно сферическую форму с размерами 64×55×50 А. Молекула содержит линии повышенной электронной плотности, приблизительно соответствующие цепям, найденным химическими методами (т. е. двум α- и двум β-цепям). Общий вид молекулы изображен на рис. 10.9. Примечательно, что, как легко различить, каждая субъединица в основном идентична структуре миоглобина (см. также разд. "Молекулярная эволюция").

Рис. 10.9. Модель молекулы гемоглобина. Места, в которых происходит связывание кислорода, обозначены через О2
Были проведены также исследования дезоксигемоглобина лошади и человека при разрешении около 3 Å. Результаты показывают, что структура субъединиц весьма похожа на структуру субъединиц оксигемоглобина лошади, но расстояние между субъединицами в оксиформе отличается на 7 Å от соответствующих значений в дезоксиформе, хотя общая форма субъединиц и молекулы в целом почти не меняется.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'