
Лизоцим
Структура лизоцима* была установлена полностью в 1965 г. при использовании разрешения 2 Å [8]. Успех в установлении структуры лизоцима был достигнут в 1960 г., когда Поляку удалось получить изоморфные производные, содержащие атомы тяжелых элементов. Первоначальная структура, установленная при разрешении 6 Å, в общих чертах была подтверждена. Оказалось, что молекула имеет эллипсоидальную форму с размерами 45×30×30 Å и заметную впадину на поверхности. Среди трех изоморфнозамещенных тяжелыми атомами производных, использованных для получения карты электронной плотности при разрешении 6 Å, были комплексный ион, включающий UO2F3-5, ион, полученный из UO2(NO3)2, а также производное о-ртутьокситолуол-n-сульфокислоты. За исключением последнего, эти производные, выбранные для изучения структуры с разрешением 6 Å, можно было использовать и для исследования с разрешением 2 Å. На рис. 10.10 приведено двумерное изображение аминокислотной последовательности и укладки цепей. Группа исследователей из Кингз-Колледжа применила методику, в основном разработанную Кендрью, Перутцем и их коллегами для исследования гемоглобина и миоглобина. Для построения модели молекулы они одновременно изучали распределение электронной плотности и использовали имеющиеся сведения о последовательности расположения аминокислот.
* (Биохимическое действие лизоцима состоит в расщеплении мукополисахаридов и в лизировании некоторых бактерий, например Micrococcus lysodeikticus. Он обнаружен в яичном белке и в слизистых выделениях человека.)
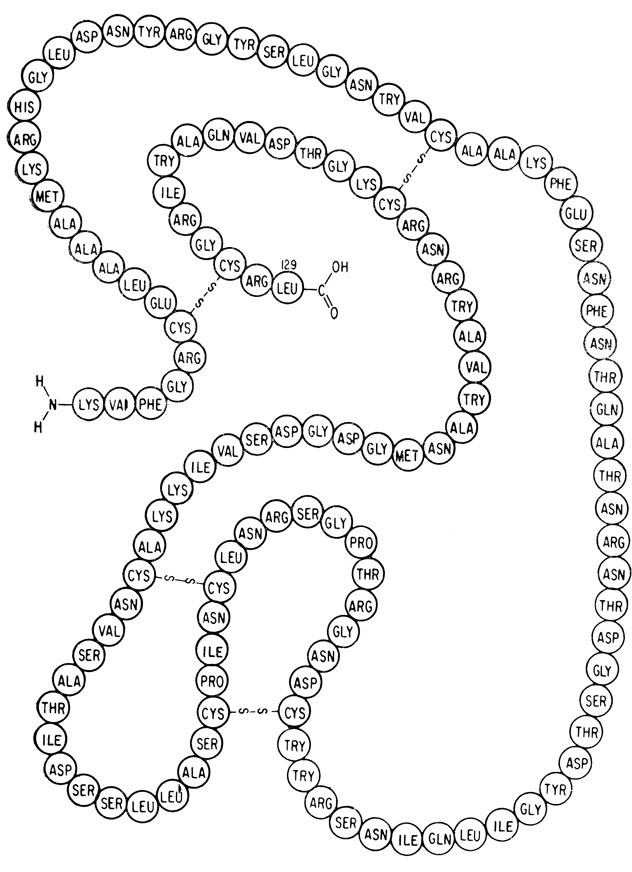
Рис. 10.10. Последовательность аминокислот в молекуле лизоцима и положение дисульфидных мостиков. Пространственная модель фермента изображена на рис. 11.11
Лизоцим состоит из 129 аминокислот. Приведенным выше способом исследователи сумели отчетливо определить местоположение 114 аминокислот. Положение остальных аминокислотных остатков было установлено на основании предположений, сделанных при изучении распределения электронной плотности, которое показывало лишь часть боковых цепей для каждой из этих аминокислот. Лизоцим содержит три участка, имеющих форму спирали, каждый из которых включает около 10 аминокислотных остатков. Имеются в виду участки, содержащие аминокислотные остатки 5-15, 24-34 и 88-96. Детали структуры видны на пространственной модели молекулы лизоцима, изображенной на рис. 10.11.
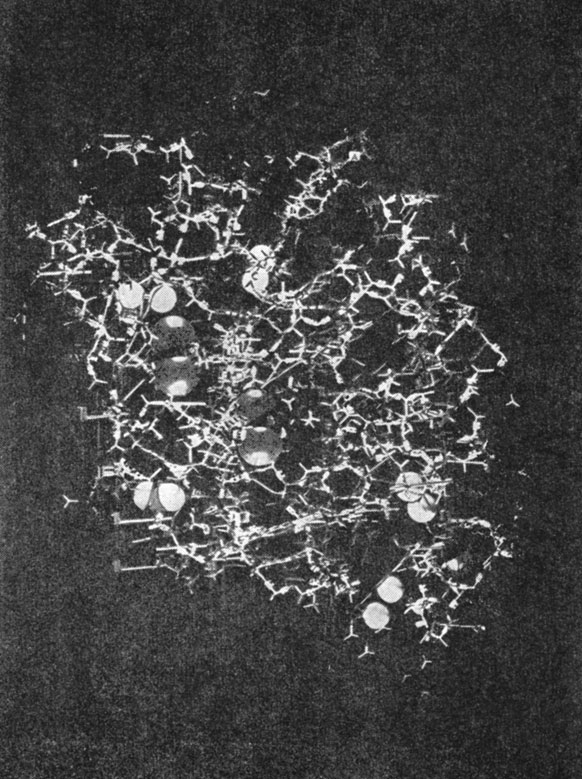
Рис. 10.11. Фотография пространственной модели лизоцима
Эти короткие спиральные участки в молекуле лизоцима на самом деле несколько искажены, поскольку расположение водородных связей оказывается промежуточным между α- и 10/3-спиралями*. Особенностью молекулы лизоцима является участок между 41 и 54 аминокислотными остатками, где цепь загибается сама на себя и образует антипараллельный складчатый слой. Такие расположение гораздо раньше предполагалось для фиброина шелка (см. раздел, посвященный фибриллярным белкам). Лизоцим похож на миоглобин и субъединицы гемоглобина в том смысле, что полярные боковые группы аминокислотных остатков расположены в его молекуле почти исключительно на внешней поверхности. Неполярные боковые цепи преимущественно находятся внутри молекулы.
* (α-Спираль состоит из 18 аминокислотных остатков, образующих 5 витков, а спираль 10/3 - это структура, в которой 10 аминокислотных остатков уложены в 3 витка. α-Спираль будет рассмотрена в следующем разделе данной главы.)
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'