
V. Реакции
А. Окисление и восстановление
В неорганической химии понятия окисление и восстановление твердо определены. Окислением и восстановлением называют перенос электронов в ходе реакции, причем при окислении происходит потеря электронов, а при восстановлении - приобретение электронов. В реакции между металлическим железом и ионом меди железо окисляется, а медь восстанавливается.

Нагляднее изображать эти стадии, записывая их отдельно. Железо теряет два электрона, окисляясь при этом
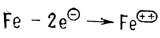
Ион меди приобретает два электрона, восстанавливаясь при этом
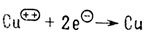
При реакции окислителя с любым соединением сам окислитель восстанавливается. Окисление и восстановление - взаимосвязанные процессы. Все реакции такого рода сбалансированы не только стехиометрически, но и по электронному заряду. Ниже приведена суммарная реакция хлорида олова (II) с перманганатом калия:
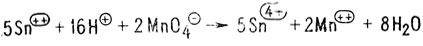
Стадии окисления и восстановления для этой реакции можно записать следующим образом:
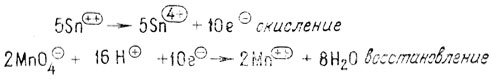
В органической химии термины окисление и восстановление не столь легко определить. Для того чтобы решить вопрос о состоянии окисления данного соединения, необходимо рассматривать его электронную плотность. Практически нет разницы в распределении электронов около атомов углерода в метане, этане или других алканах. У этилена расположение π-связи в пространстве таково, что электронная плотность каждого из атомов углерода меньше, чем при σ-связи в этане.
π-Связям в ацетилене соответствует даже еще более низкая электронная плотность у двух атомов углерода, чем в этилене или этане. Таким образом, эти соединения по степени их окисления можно расположить в такой ряд: ацетилен>этилен>этан.
На стр. 320 производные метана, содержащие связи углерод- кислород, перечислены в порядке возрастания степени окисления углеродного атома. Двуокись углерода является соединением, в котором углерод находится в высшей стадии окисления.
При полном сгорании углеводорода образуются двуокись углерода и вода
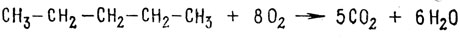
В отличие от реакций окисления - восстановления неорганических соединений для органических соединений написать раздельно реакции для стадии окисления и стадии восстановления труднее, однако легко видеть, что алкан окисляется, в то время как кислород восстанавливается.
Часто для проведения контролируемого окисления применяют специально подобранные условия и специфические реагенты. Например, этанол в присутствии бихромата можно превратить в ацетальдегид или уксусную кислоту
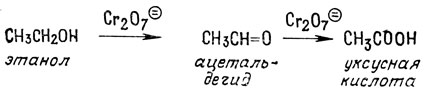
Поскольку ацетальдегид легко окисляется до уксусной кислоты, он может быть выделен только в том случае, если непрерывно отгонять его из реакционной смеси по мере образования. Если исходным спиртом служит пропанол, единственным продуктом окисления является ацетон
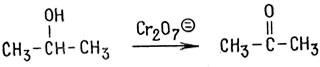
Реакция останавливается на этой стадии, поскольку для дальнейшего окисления потребовался бы разрыв связи углерод-углерод, что требует большой затраты энергии.
Легкость окисления альдегидов, о которой шла речь выше, лежит в основе реакции их идентификации. Многие сахара содержат альдегидные группы. Их легко можно идентифицировать, окисляя при помощи медной соли винной кислоты.
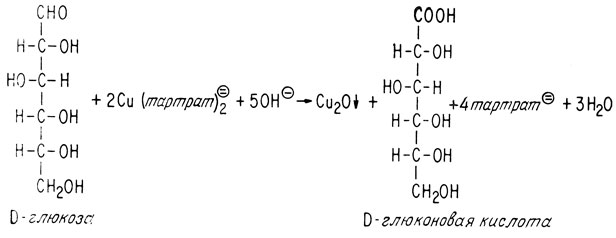
Осаждение закиси меди указывает на окисление альдегидной группы; образующаяся в результате окисления кислота в этих условиях разлагается.
В арсенале органической химии имеются реакции, позволяющие восстанавливать карбоновые кислоты до карбонилсодержащих соединений, спиртов и даже до углеводородов. Можно восстанавливать также альдегиды и кетоны. Селективное восстановление можно осуществлять под действием металлических реагентов, например алюмогидрида лития и диборана.
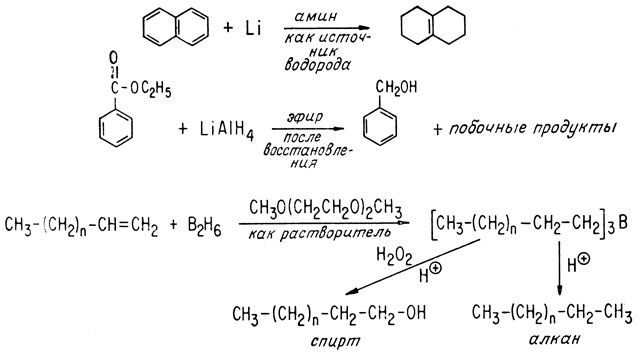
Одним из наиболее широко используемых реагентов в органической химии является реактив Гриньяра. При реакции алкилгалогенидов с металлическим магнием в отсутствие влаги в эфире в качестве растворителя образуется алкилмагнийгалогенид - реактив Гриньяра
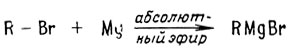
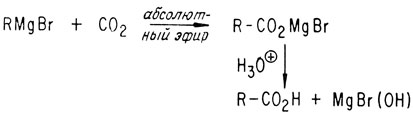
Это соединение может реагировать с двуокисью углерода, образуя карбоновые кислоты. В окислительной части суммарной реакции металлический магний превращается в ион магния с положительным зарядом, равным двум.
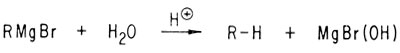
При взаимодействии водных растворов кислот с реактивом Гриньяра получаются углеводороды
В реакциях окисления и восстановления могут участвовать также соединения, содержащие связь углерод-азот. На стр. 327 приведен ряд азотсодержащих производных метана. Высшая степень окисления углерода (из приведенных соединений) у цианистого водорода. Ближе всего к двуокиси углерода находится карбодиимид RN=C=NR. Такие соединения существуют, но они весьма реакционноспособны.
Соединения, содержащие имино- или нитрильную группу, можно восстанавливать теми же реагентами, что и кислородсодержащие соединения. Продуктами восстановления таких азотсодержащих соединений обычно являются амины
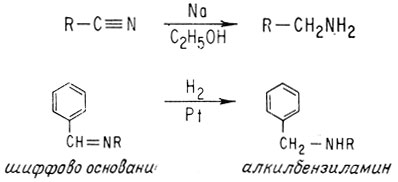
Прежде чем закончить этот раздел, упомянем о восстановлении путем присоединения водорода. Ранее такое восстановление было показано для этилена, а здесь - для имина (шиффово основание). Благородные металлы, например платина или палладий, могут поглощать газообразный водород и катализировать его присоединение к кратным связям.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'