
Б. Реакции замещения и присоединения
Данные о скоростях реакций (или изучение их кинетики) дают информацию о последовательности стадий или о механизме реакций. Химическое превращение может включать много индивидуальных стадий, из которых одни протекают медленнее, чем другие. Именно эта медленная стадия и определяет скорость всего процесса. Подавляющее большинство химических реакций являются мономолекулярными или бимолекулярными реакциями, что означает, что в стадии, определяющей скорость протекания всей реакции, участвует один или два реагента. Экспериментально скорости реакций в растворе обычно зависят от концентраций одного или более реагентов или продуктов. Обычно это выражают при помощи уравнения скорости реакции, согласно которому скорость является произведением концентрации реагентов и константы скорости k:
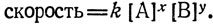
Индексы x и y показывают порядок реакции по каждому из реагентов. Следует отметить, что порядок реакции - это экспериментально определяемая зависимость скорости реакции от концентрации каждого из реагентов. С другой стороны, "молекулярность" означает число молекул реагентов, участвующих в реакции. Она устанавливается на основании изучения механизма реакции.
Реакции замещения, происходящие между алкоголятом и бромистым алкилом и приводящие к образованию простого эфира, называют реакциями SN2. Это сокращенное обозначение реакции "замещение нуклеофильное бимолекулярное". Механизм реакции и ее скорость можно представить следующим образом:
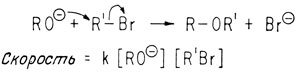
Эта реакция является не только бимолекулярной, но и имеет второй порядок (т. е. первый порядок по каждому из реагентов). Нуклеофил - это реагент, обладающий неподеленной парой электронов и атакующий атом с меньшей электронной плотностью.
Реакции SN2 представляют собой одностадийные реакции, в ходе которых происходит и разрыв, и образование связи. Если замещаемая группа присоединена к асимметрическому центру, происходит обращение конфигурации у этого центра.
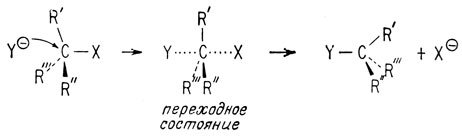
Можно рассматривать переходное состояние, в котором атакующая группа Y, и группа X, место которой она занимает, обе могут быть частично связаны с углеродом, содержащим три заместителя. Легко видеть, что три алкильные группы в образовавшемся продукте расположены в пространстве так, что они образуют зеркальное изображение расположения этих же групп в исходном соединении. Изящным примером, подтверждающим SN2-механизм, может служить реакция оптически активного 2-октилиодида и иона радиоактивного йода
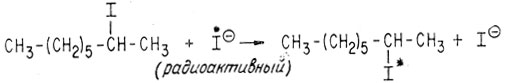
Исходный иодид представляет собой D-изомер. Реакция с ионом радиоактивного йода приводит к образованию L-изомера и рацемизации. В пределах ошибки эксперимента скорость рацемизации такая же, как и скорость образования радиоактивного йодистого алкила.
Возможно, что реакция замещения идет в две стадии: вначале происходит ионизация молекулы, приводящая к образованию иона карбония, который затем вступает в реакцию с нуклеофилом.
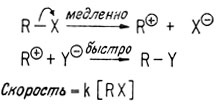
Поскольку R-X - единственная молекула, принимающая участие в стадии, определяющей скорость реакции, реакция мономолекулярна. Путем измерения скорости реакции при различных концентрациях было установлено, что скорость имеет первый порядок по R-X. Реакции такого типа обозначают как SN1, что означает "замещение нуклеофильное мономолекулярное". Из механизма реакции ясно, что скорость реакции не зависит от природы используемого нуклеофила и от его количества.
Алкилгалогениды, способные до некоторой степени стабилизовать ион карбония, реагируют по механизму SN1. В качестве примеров приведем третичные и некоторые вторичные алкилгалогениды (первичные алкилгалогениды имеют общую формулу RCH2X:
вторичные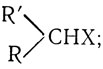 третичные
третичные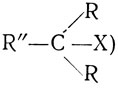
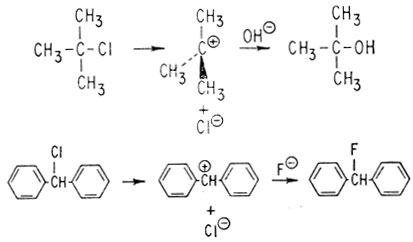
Поскольку при реакции SN1 образуется симметричное промежуточное соединение, в тех случаях, когда замещаемая группа присоединена к асимметрическому центру, всегда происходит полная рацемизация.
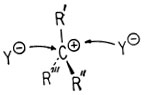
Нуклеофил Y- может с одинаковой вероятностью атаковать плоский ион карбония с любой стороны.
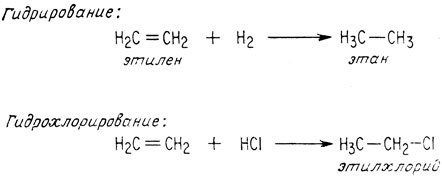
Соединение, содержащее углерод-углеродную двойную связь, называется ненасыщенным, поскольку оно обладает способностью присоединять другие атомы. Эти реакции присоединения обычно являются экзотермическими, т. е. идут с выделением энергии. Это означает, что получаемые в результате таких реакций продукты более стабильны, чем исходные соединения, главным образом потому, что σ-связи прочнее π-связей. Тем не менее реакции гидрирования и полимеризации требуют участия катализаторов вследствие того, что некатализируемая реакция при обычных температурах идет слишком медленно.
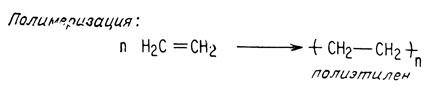
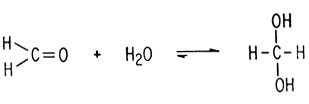
Карбонильные соединения также являются ненасыщенными и могут подвергаться атаке нуклеофилами. Формальдегид в воде находится почти целиком в виде диола (или гидрата)
При замене атома водорода алкильным заместителем положительная поляризация атома углерода карбонильной группы уменьшается. В соответствии с этим ацетальдегид в воде гидратируется только примерно на 50%, а ацетон не гидратируется совсем.
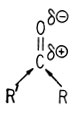
Образование шиффовых оснований представляет собой реакцию присоединения, в которой амин служит нуклеофилом

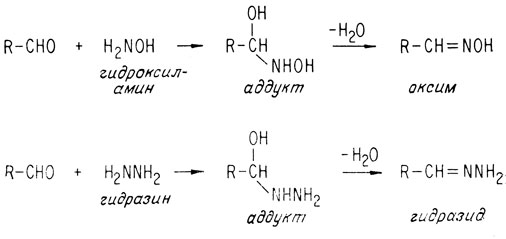
Аналогичными реакциями являются реакции присоединения гидроксиламинов или гидразина, приводящие к образованию соответственно оксимов и гидразидов
Очень удобным объектом для нуклеофильной атаки (присоединения) являются хлорангидриды карбоновых кислот, например хлористый ацетил
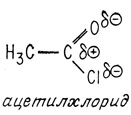
Атом углерода в карбонильной группе положительно поляризован вследствие оттягивания электронов под влиянием связанных с ним более электроотрицательных атомов кислорода и хлора. Поэтому атом углерода особенно подвержен нуклеофильной атаке. В результате атаки молекулой аммиака образуется ацетамид
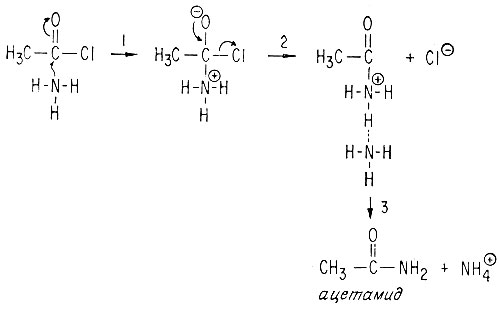
1 - атака аммиаком, под действием которой разрывается слабая π-связь; 2 - π-связь вновь восстанавливается и отщепляется ион хлора; 3 - протонированный продукт переносит протон к соседней молекуле растворителя.
В результате атаки молекулой воды образуется уксусная кислота (последовательность стадий такая же, как была указана выше)
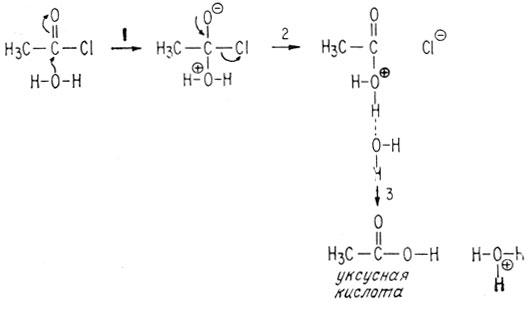
Поскольку электронная пара в аммиаке связана менее прочно, чем воде (т. е. аммиак является более сильным нуклеофилом), ацетамид образуется быстрее, чем уксусная кислота.
Различия в основности и нуклеофильности, которые были показаны для аммиака и воды, сохраняются также и в их производных метана - метиламине и метиловом спирте. Метиламин, так же как и аммиак, представляет собой основное и нуклеофильное соединение, а метиловый спирт, как и вода, менее основен и обладает более слабыми нуклеофильными свойствами.
Метиленимин также напоминает формальдегид в том смысле, что входящий в него углерод, связанный двойной связью, положительно поляризован и подвержен нуклеофильной атаке. Цианистый водород похож на карбоновую кислоту, поскольку он обладает слабыми кислотными свойствами. Однако анион, образующийся после отщепления протона из цианистого водорода, не стабилизирован вследствие резонанса, а потому цианистый водород - гораздо более слабая кислота, чем средняя карбоновая кислота. Сложные эфиры образуются при взаимодействии кислот со спиртами. При действии кислоты эфир может расщепляться на составляющую его кислоту и спирт. Этот процесс известен под названием гидролиза; он обратим.
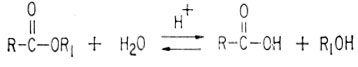
Если расщепление проводится в щелочной среде, такая реакция называется омылением. Эта реакция необратима, поскольку получающаяся кислота вступает в дальнейшую реакцию с основанием, образуя карбоксилат-ионы. Последние не подвержены нуклеофильной атаке благодаря наличию анионного заряда.
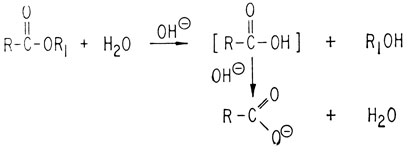
Реакции расщепления типичных сложных эфиров обычно включают разрыв ацильной связи.
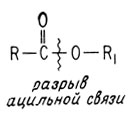
Это можно показать, проводя реакцию с меченым О18. Если гидролизовать сложный эфир водой, обогащенной О18, образующийся спирт метки не содержит.
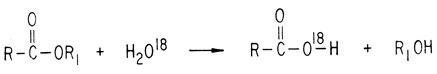
Аналогичным образом омыление эфира, содержащего О18, свидетельствует о расщеплении ацильной связи.
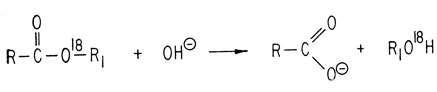
В некоторых случаях может происходить расщепление алкильной связи.
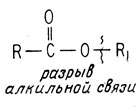
Такое расщепление происходит в том случае, если взятый эфир может ионизироваться с образованием стабильного иона карбония
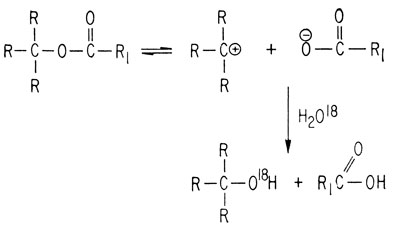
Катализируемые кислотами этерификация, гидролиз и омыление протекают как реакции присоединения - элиминирования. Их механизм установлен на основании изучения реакций с меченым О18.

Вследствие легкости переноса протона метка (О18) оказывается в обеих группах -О- и -ОН
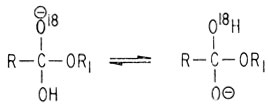
Поскольку стадия нуклеофильного присоединения обратима, происходит переход О18 к растворителю
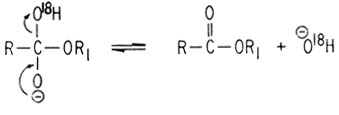
Переход метки можно объяснить только по механизму присоединения - элиминирования. В кислотных условиях реакция протекает аналогично:
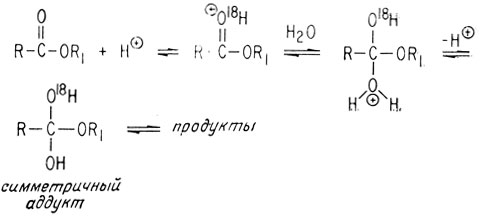
Обратимость реакций, ведущих к образованию симметричного аддукта, должна приводить к переносу метки О18 к растворителю. В этих опытах, проводившихся как в кислой, так и в щелочной среде, метка О18 появляется в растворителе до проведения гидролиза или омыления сложного эфира. Это может происходить только в том случае, если молекула воды или ион гидроксила присоединяются к карбонильной группе.
Обе реакции завершаются отщеплением от образовавшихся аддуктов алкоксильной группы, что схематически изображено ниже:
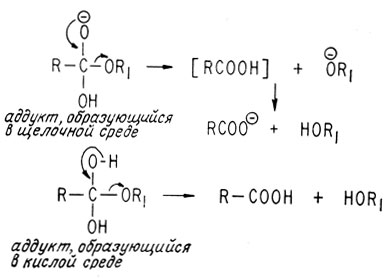
Выше мы уже рассматривали образование амида. Реакции гидролиза и омыления амидов происходят аналогично рассмотренным выше реакциям сложных эфиров.
В рассмотренных нами химических реакциях наблюдается гетеролитическое расщепление связей
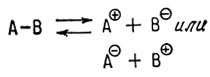
Гетеролизом связи называется такой ее разрыв, при котором пара электронов, принадлежавшая ранее двум связываемым атомам, целиком отходит к одному из них. При гетеролитическом распаде образуются ионы.
Может происходить и гомолитический разрыв связей

При этом пара электронов связи разъединяется и образуются свободные радикалы. Часто термическое и фотохимическое расщепление связей является гомолитическим. Образовавшиеся радикалы могут инициировать цепные реакции.
Приведенный ниже пример цепной радикальной реакции позволяет выявить некоторые особенности радикалов. Атом брома может приводить к образованию из молекулы метана метального радикала
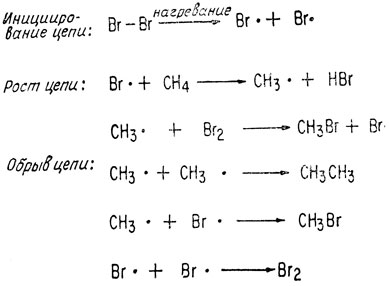
Образовавшийся метальный радикал может замещать атом брома в молекуле брома. Радикалы легко рекомбинируют. Так, при столкновении двух радикалов происходит экзотермическое образование связи. Цепные реакции развиваются в тех случаях, когда концентрация реагирующих молекул (в приведенном примере - метана) достаточно высока. При уменьшении концентрации преобладает рекомбинация радикалов и обрыв цепей.
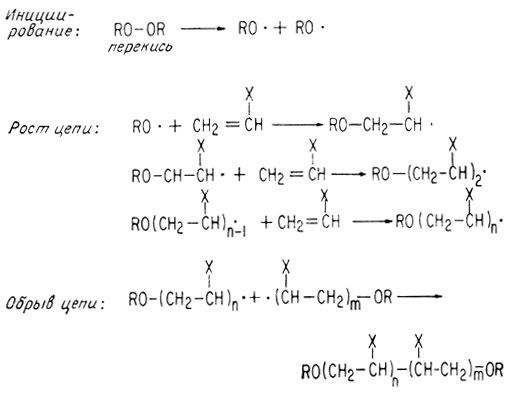
Может происходить присоединение радикалов к ненасыщенным молекулам. Такие реакции лежат в основе многих процессов полимеризации. Радикалы являются теми инициирующими частицами, которые могут, присоединяясь к двойной связи алкена, образовывать новый промежуточный радикал. Затем эти новые радикалы могут вновь присоединяться к мономерному алкену. Стационарная низкая концентрация радикалов устанавливается благодаря быстрому присоединению радикалов к молекулам алкенов. Если концентрация алкена становится слишком низкой, начинает преобладать обрыв цепи. Обрыв цепи происходит за счет соединения двух цепей, в результате которого свободные радикалы, находятся на к6йцахекаждой цепи, рекомбинируют.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'