
1.3. Общие подходы к изучению мембран
При изучении интактных тканей и клеток или тканей и клеток, фиксированных в щадящих условиях, мы получаем достаточно много сведений о химической природе и физических свойствах мембранных барьеров и материалов, из которых эти барьеры построены, а также об активности ферментов в различных частях клетки, отгороженных мембранами. В двух следующих главах описаны результаты, полученные при изучении осмотических (гл. 2) и электрических свойств клеток (гл. 3). Исключительно большое значение имеют гистохимические методы, позволяющие с помощью специфических цветных реакций выявить локализацию отдельных ферментов и веществ, из которых построена мембрана. Например, применяя методы гистохимического анализа, можно идентифицировать кислую фосфатазу в небольших цитоплазматических органеллах. Для этого используют специальные хромогенные субстраты, а затем полученные препараты рассматривают под оптическим микроскопом. Другой способ исследования основан на использовании электронной микроскопии. Освобождающийся в результате ферментативной реакции неорганический фосфат осаждают свинцом (электроноплотный металл). Последующее изучение системы под электронным микроскопом дает подробную информацию о природе исследуемой органеллы. Комбинированные методы исследования, включающие электронную микроскопию и радиоавтографию, позволяют идентифицировать и точно определить внутриклеточную локализацию заново синтезируемых молекул, которые включают радиоактивные предшественники.
Участие индивидуальных мембран или органелл в отдельных процессах, протекающих в организме, легко изучать, если удается изолировать эти процессы из сложной полифункциональной системы целого организма. Глубина такого разделения процессов может варьировать в различных исследованиях от изучения перфузируемых органов и срезов тканей до экспериментов с индивидуальными макромолекулами, в том числе и с ферментами (рис. 12). Такое упрощение анализируемой системы открывает широкие возможности для исследований, однако оно таит в себе и серьезные опасности, поскольку при этом нарушаются связи, существующие между данным процессом и другими процессами, протекающими в клетке, и ликвидируется, таким образом, пространственный и функциональный контроль, который накладывается структурой и организацией мембран.
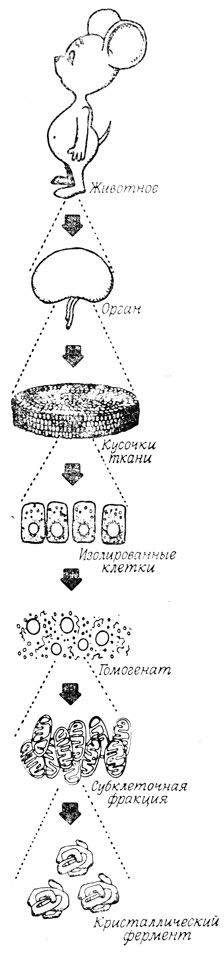
Рис. 12. Различные уровни исследования биологических процессов - от процессов, протекающих в целом организме, до процессов, осуществляемых отдельными макромолекулами
Помимо этих крайних случаев, существуют экспериментальные подходы, состоящие в изучении отдельных типов изолированных клеток и изолированных органелл или мембранных фрагментов, сохранивших большую часть своей функциональной активности и структурной организации. Выделение таких субклеточных структур из различных источников стало теперь обычной процедурой. В ее основе лежит получение относительно гомогенной популяции изучаемых клеток, разрушение их в щадящих условиях в соответствующих защитных средах и фракционирование различных частиц, содержащихся в гомогенате, методами центрифугирования.
Обычно исходным материалом для выделения субклеточных структур служат либо отдельные клетки, взятые из тела животного, либо клетки, выращенные в культуре, либо, наконец, кусочки тканей. Ткани обычно гетерогенны, что обусловлено наличием в них крови (которую можно удалить перфузией), а также нескольких клеточных популяций. Как правило, такая гетерогенность допустима и не создает серьезных препятствий для выделения различных субклеточных структур в относительно чистом виде. Однако иногда сначала необходимо выделить гомогенную популяцию клеток. Процедура выделения довольно сложна, особенно при работе с высокодифференцированными тканями, а кроме того, часто при этом выход клеток оказывается довольно низким или же их структура в какой-то степени нарушается.
Методы выделения клеток из тканей иногда предусматривают чисто механические воздействия на обрабатываемую ткань. Однако в большинстве случаев эти процедуры включают комбинацию щадящих механических воздействий с обработкой ткани ферментами (обычно коллагеназой и гиалуронидазой) или хелатобразующими агентами, например ЭДТА, который препятствует ассоциации клеток. Критерием целостности выделенных клеток служит их способность не пропускать в цитоплазму такие красители, как эозин или трипановый синий, а также катализировать метаболические процессы, требующие высокого уровня клеточной организации.
При работе с тканями растений, бактериями и грибами перед исследователями встает еще одна задача, состоящая в том, чтобы подобрать такие методы гомогенизации, которые разрушили бы клеточные стенки, но не повредили бы хрупкие внутриклеточные органеллы. Обычный путь решения указанной проблемы связан с удалением или ослаблением клеточной стенки перед гомогенизацией клеток. Это достигается предварительной инкубацией исходного материала с ферментами, чаще всего гликозидазами, которые приводят к специфической деградации полимеров, входящих в состав клеточной стенки. Наибольшее распространение получили лизоцим и ферменты, выделенные из кишечника улитки. Модифицированные клетки, получаемые в результате такой обработки, называются сферопластами или, если клеточная стенка полностью удалена, протопластами.
Клетки, подготовленные указанным способом, гомогенизируют в предельно мягких условиях, позволяющих разрушить плазматические мембраны и сохранить внутриклеточные органеллы. К таким мягким методам гомогенизации относятся, например, продавливание суспензии клеток через узкие отверстия или вращение цилиндрического пестика в концентрической трубке, содержащей суспензию клеток.
Разрушение плазматической мембраны может быть достигнуто также при выдерживании клеток под высоким давлением азота с последующим резким уменьшением внешнего давления или в гомогенизаторе при быстром вращении металлических ножей блендера. Очень устойчивые клетки разрушают, растирая их с небольшими стеклянными шариками или продавливая замороженную клеточную массу через узкие отверстия.
Среда, в которой суспендируют биологический материал перед гомогенизацией и при последующих препаративных процедурах, представляет собой буферный водный раствор неэлектролита, который должен отвечать двум требованиям: не быть активным участником метаболизма и не проникать быстро через мембраны. Этим требованиям хорошо удовлетворяет сахароза. Концентрацию раствора подбирают таким образом, чтобы среда была изоосмотической, т. е. чтобы ее осмотическое давление было равно осмотическому давлению внутри клетки (около 250-350 мосмоль/л). Конечно, такой раствор, не содержащий электролитов, отличается по ионному составу от среды, окружающей органеллы внутри клеток. Иногда для облегчения деструкции клеток в качестве инкубационной среды применяют гипотонические растворы, вызывающие у клеток осмотический шок.
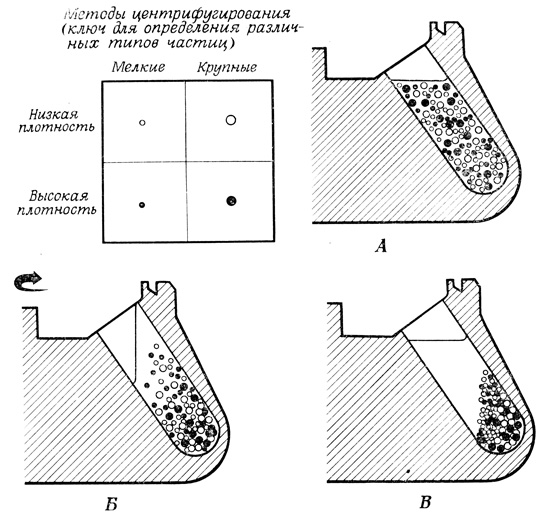
Рис. 13. Дифференциальное центрифугирование в угловом роторе. А - до центрифугирования. Во время (Б) и после (В) центрифугирования
Для разделения клеточных органелл и фрагментов мембран, содержащихся в гомогенате, пользуются методами центрифугирования, позволяющими фракционировать частицы по размеру и плотности. При дифференциальном центрифугировании (рис. 13) частицы оседают с различной скоростью, которая в основном зависит от их размеров. Следовательно, в обычных условиях центрифугирования в первую очередь оседают наиболее крупные частицы (ядра) и в последнюю очередь - наиболее мелкие, (микросомы и рибосомы). Микросомы представляют собой смесь небольших мембранных пузырьков и мембранных фрагментов, довольно различных по составу. Некоторые из этих мелких частиц существуют в интактных клетках, однако значительная часть их образуется при гомогенизации из более крупных мембранных систем, в том числе из эндоплазматической сети, плазматической мембраны и комплекса Гольджи. При изоплотностном центрифугировании (рис. 14) частицы оседают в среде с градиентом плотности до тех пор, пока не попадут в зону, где плотность среды такая же, как и у них самих. Частицы, имеющие низкую плотность, характеризуются, как правило, высоким содержанием липидов, а частицы с высокой плотностью - высоким содержанием белка и (или) нуклеиновых кислот. Используемые градиенты могут быть либо непрерывные, когда плотность постепенно увеличивается от вершины пробирки к ее дну, либо ступенчатые, когда в пробирку наслаиваются один за другим несколько слоев с различной плотностью, Если растворенное вещество, изменение концентрации которого создает градиент плотности, имеет низкий молекулярный вес, то градиент плотности является одновременно и градиентом осмотического давления. Альтернативный вариант предусматривает поддержание постоянной тоничности у всего раствора с помощью низкомолекулярных веществ и создание градиента плотности высокомолекулярных веществ, таких, как полисахароза (фикол).

Рис. 14. Изоплотностное центрифугирование в роторе с подвесными стаканами. Обозначения такие же, как и на рис. 13
Дифференциальное центрифугирование в угловом роторе применяется в препаративных целях и, как правило, не приводит к полному разделению компонентов в смеси органелл. Изоплотностное центрифугирование в роторе с подвесными стаканами приводит к хорошему разделению компонентов смеси, однако может применяться только для фракционирования сравнительно небольших количеств материала. По этой причине процедура фракционирования субклеточных частиц состоит из нескольких последовательных этапов. Сначала компоненты фракционируют по размеру, а затем - по плотности, получая в итоге небольшие количества субклеточных фракций, характеризующихся большей гомогенностью, чем препараты, выделенные с использованием какой-либо одной методики. Зональные роторы (рис. 15), в которых частицы могут разделяться как по скорости седиментации, так и по плотности, обеспечивают высокое разрешение и фракционирование достаточно больших количеств материала. Однако эти роторы довольно дороги, а их эксплуатация связана с определенными трудностями.
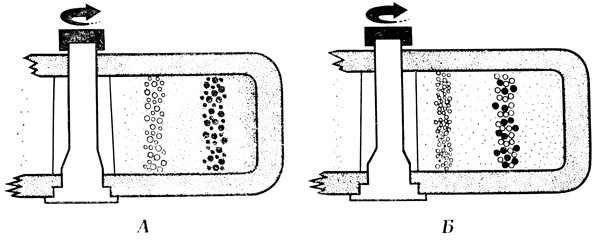
Рис. 15. Центрифугирование в зональном роторе. А - разделение частиц по плотности. Б - разделение частиц по скорости седиментации
Некоторые изолированные клеточные компоненты обладают достаточно сложной структурой и содержат мембраны различного типа, разделяющие их внутреннее пространство на отсеки. К числу таких компонентов относятся, например, митохондрии, хлоропласты и фрагменты нервных окончаний. В этих случаях для выяснения локализации отдельных составных частей органелл их подвергают дальнейшей деструкции и фракционированию.
Существуют два взаимосвязанных способа фракционирования субклеточных частиц; это, во-первых, аналитическое центрифугирование, с помощью которого решаются вопросы, касающиеся внутриклеточной локализации отдельных компонентов и процессов, и, во-вторых, препаративное центрифугирование, которое применяют в том случае, когда в задачу исследования входит подробное изучение свойств отдельных внутриклеточных компонентов (рис. 16). Однако, перед тем как использовать выделенные фракции для решения тех или иных задач, их следует тщательно охарактеризовать. Для этой цели применяются методы световой и электронной микроскопии, а также различные маркеры, посредством которых измеряют относительное содержание меченного маркером компонента в исходном гомогенате и в выделенной фракции. Для маркирования можно пользоваться как химическими реагентами, так и ферментативными и иммунохимическими реакциями. Главное требование, предъявляемое к маркерам,- это способность локализоваться или концентрироваться в определенных, заранее известных компонентах клетки. По распределению маркеров в выделенных фракциях можно судить о содержании в них искомых компонентов. Выбор маркеров облегчается тем, что обычно (хотя и не всегда) одни и те же маркеры могут быть использованы для идентификации аналогичных компонентов в клетках различных типов. Приведем некоторые общепринятые маркеры для различных органелл клетки:
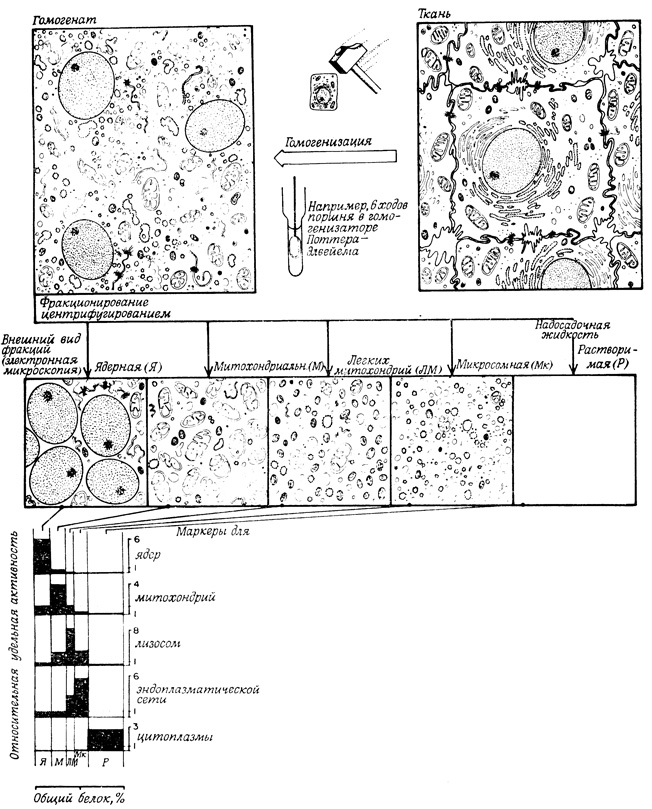
Рис. 16. Схема получения клеточного гомогената и разделения его на субклеточные фракции (препаративное фракционирование клеток печени). Относительные удельные активности нескольких маркеров, представляющие собой отношение удельной активности фракции к удельной активности гомогената, отражают ту степень, в которой каждая выделенная фракция обогащена или обеднена данной органеллой. Ширина каждого столбика соответствует выраженному в процентах количеству белка во фракции, а площадь столбика - содержанию маркера (и органеллы) во фракции. Удельная активность - это активность, приходящаяся на 1 мг белка. 'Теоретический' максимум относительной удельной активности каждого маркера обратно пропорционален вкладу данной органеллы в массу клетки

Когда проводятся измерения, связанные с распределением маркеров, очень важно правильно учесть весь материал, присутствующий в исходном гомогенате.
Часто ферменты, ассоциированные с внутренней поверхностью мембраны выделяемой частицы или содержащиеся в растворе внутри частицы, недоступны субстрату, присутствующему в инкубационной смеси. Если разрушить замкнутую мембрану таких частиц (например, гипотоническим шоком, детергентами или ультразвуком), первоначально скрытые молекулы ферментов становятся доступными субстрату и их ферментативную активность можно количественно измерить. Такое маскирование ферментативной активности, свидетельствующее о внутриклеточной компартментализации и сыгравшее решающую роль при открытии лизосом, необходимо учитывать во всех экспериментах с внутриклеточными ферментами.
Количественные измерения, проводимые с помощью маркеров в препаративных экспериментах, могут служить критерием того, насколько материал загрязнен посторонними примесями. Это позволяет судить также о том, какая примесь может оказать влияние на измерение количества исследуемого материала или на ферментативную активность. Часто для изучения ферментативных реакций вполне пригодны препараты умеренной чистоты. Однако для детального химического или физического анализа органелл очень важно, чтобы степень чистоты исследуемого материала была достаточно высокой.
В аналитических экспериментах данные по распределению маркеров дают возможность судить о наличии в препарате тех компонентов, которые локализованы в тех же областях клетки, что и маркеры. Подобные подходы оказываются особенно важными при идентификации ферментов, входящих в состав органелл, таких, как плазматическая мембрана или лизосомы, составляющих по массе лишь небольшую часть клетки и поэтому труднодоступных в чистом виде.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'